
已知醋酸溶液中有如下平衡:CH3COOH⇌CH3COO﹣+H+,下列试剂能使CH3COOH的电离程度增大且c(H+)减小的是( )
|
| A. | CH3COOH | B. | H2O | C. | CH3COONa | D. | HCl |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
加水稀释或加入能和氢离子反应的物质能促进醋酸电离且溶液中氢离子浓度减小,据此分析.
解答:
解:A.向溶液中加入醋酸,醋酸浓度增大,平衡向正反应方向移动,但醋酸的电离程度减小,故A错误;
B.加水稀释促进醋酸电离,醋酸的电离程度增大,且氢离子浓度减小,故B正确;
C.向溶液中加入醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,故C错误;
D.向溶液中加入氯化氢,氢离子浓度增大,抑制醋酸电离,故D错误;
故选B.
点评:
本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
100℃时,KW=1×10﹣12,对纯水的叙述正确的是( )
|
| A. | pH=6显弱酸性 | B. | C(H+)=10﹣6mol/L,溶液为中性 |
|
| C. | KW是常温时的10﹣2倍 | D. | 温度不变冲稀10倍pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
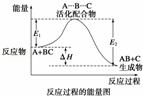
|
| A. | 反应过程可表示为 |
|
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 |
|
| C. | 正反应的热效应为△H=E1﹣E2<0,所以正反应为放热反应 |
|
| D. | 此图中逆反应的热效应△H=E1﹣E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的PH大于7,表中判断合理的是( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
|
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用不正确的是( )
|
| A. | 原子核内有18个中子的氯原子: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 钒原子电子排布式:[Ar]3d34s2 |
|
| D. | NH4Br的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2,在一定条件下发生反应.下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )

|
| A. | SO2的转化率 | B. | 混合气体的密度 |
|
| C. | 密闭容器内的压强 | D. | O2的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置Ⅰ为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3 K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
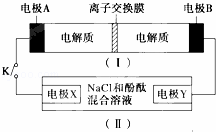
|
| A. | K+从右到左通过离子交换膜 |
|
| B. | 电极A的反应式:I3﹣+2e﹣=3I﹣ |
|
| C. | 电极X的反应式:4OH﹣﹣4e﹣═O2↑+2H2O |
|
| D. | 当电极Y有0.2mole﹣转移时,产生0.1molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
①3p轨道上只有一对成对电子的原子;②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;④正三价的阳离子结构与氖相同的原子。
| A.①②③④ | B.③①②④ | C.②③①④ | D.②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
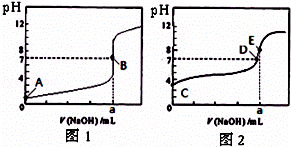
|
| A. | 滴定盐酸的曲线是图2 |
|
| B. | 达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A﹣) |
|
| C. | 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
|
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A﹣)>c(Na+)>c(H+)>c(OH﹣) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com