
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
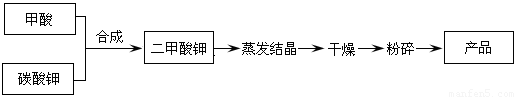
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式:???????????????????????????????????????????????????????????? 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是???????????? (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是???????????????????????????????????????? 。
②上述弗米产品中二甲酸钾的质量分数为????????????? 。(写出计算过程)
(1)4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O(2分)
(2)①酚酞(2分)溶液由无色恰好变成浅红色且在半分钟内不褪色(2分)
②96.2%(6分)
【解析】
试题分析:(1)足量的甲酸生成酸式盐,所以碳酸钾只能生成二氧化碳;(2)终点时氢氧化钠与二甲酸钾恰好完全反应生成正盐,甲酸是弱酸,所以其正盐水解溶液为碱性,故使用在碱性条件下变色的酚酞做指示剂;终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色;
(3)KH(HCOO)2+ NaOH=K2(HCOO)2 +Na2(HCOO)2+ H2O
n(KH(HCOO)2)= n(NaOH)= 18.50×10-3×0.10=1.85×10-3mol
产品中二甲酸钾的质量分数为1.85×10-3×130×10÷2.5=0.962
考点:考查物质的含量的计算分析有关问题。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化学 来源:上海中学、复旦附中等八校2011届高三联合调研化学试题 题型:058
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水.
二甲酸钾的生产工艺流程如下:
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:


①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:________.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在________℃∽________℃,反应物料比应选择________.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是__________.
③蒸发结晶后需进行的操作步骤是________、________.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5 g,将其全部溶解在水中,配制成250 mL未知浓度的溶液,取出25.00 mL于锥形瓶中,再滴加2~3滴指示剂,用0.10 mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50 mL.
①加入的指示剂是________(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是________________.
②上述弗米产品中二甲酸钾的质量分数为________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
 |
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
表2 反应物料比对产品回收率的影响
| 反应物料比 | 2∶1 | 3∶1 | 4∶1 | 5∶1 | 6∶1 | 7∶1 |
| 产品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
备注:表2中反应物料比为甲酸和无水碳酸钾的物质的量之比。
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:
。
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在 ℃∽ ℃,反应物料比应选择 ∶ 。由表1可知反应温度过高,反应回收率反而会降低,其原因可能是 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:江苏省无锡市2010年高三教学情况调查(一) 题型:填空题
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
 |
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
|
反应温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
产品回收率(%) |
75.6 |
78.4 |
80.6 |
82.6 |
83.1 |
82.1 |
73.7 |
表2 反应物料比对产品回收率的影响
|
反应物料比 |
2∶1 |
3∶1 |
4∶1 |
5∶1 |
6∶1 |
7∶1 |
|
产品回收率(%) |
0 |
38.4 |
82.6 |
83.6 |
84.5 |
84.8 |
备注:表2中反应物料比为甲酸和无水碳酸钾的物质的量之比。
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:
。
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在 ℃∽ ℃,反应物料比应选择 ∶ 。由表1可知反应温度过高,反应回收率反而会降低,其原因可能是 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com