
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)![]() 2HI(g) ΔH1=-9.48 kJ·mol-1
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g) ΔH2=+26.48 kJ·mol-1
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
【答案】C
【解析】
A. 根据反应热ΔH=生成物的总能量-反应物的总能量,说明①中反应物的总能量大于②中反应物的总能量,由于物质在气态时的能量大于在固态时的能量,则①中的I2为气态,②中的I2为固态,故A正确;
B. 根据A选项分析得到②的反应物总能量比①的反应物总能量低,故B正确;
C. 由于两个反应的产物相同、状态相同,热稳定性也相同,故C错误;
D. 根据盖斯定律,②-①得I2(s)![]() I2(g) ΔH=ΔH2-ΔH1=+26.48 kJ·mol1-(-9.48 kJ·mol1)=+35.96 kJ·mol1,说明1 mol固态碘升华为碘蒸气需要吸收35.96 kJ的热量,故D正确。
I2(g) ΔH=ΔH2-ΔH1=+26.48 kJ·mol1-(-9.48 kJ·mol1)=+35.96 kJ·mol1,说明1 mol固态碘升华为碘蒸气需要吸收35.96 kJ的热量,故D正确。
综上所述,答案为C。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
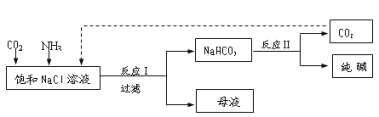
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
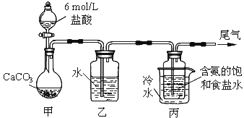
(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
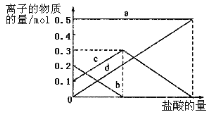
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验装置或操作的说法中,正确的是( )
A.图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2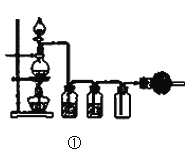
B.图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性:Cl>Br>I
C.图③实验中试管内的溶液中会生成血红色沉淀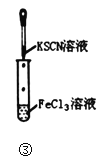
D.图④操作中可用酒精提取溴水中的溴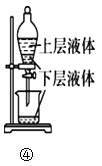
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确且能合理解释事实的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时问后,溶液变蓝:4H++4I-+O2=2I2+2H2O
C.向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO![]() +2OH-=MgCO3↓+2H2O
+2OH-=MgCO3↓+2H2O
D.向含0.1molFeBr2的溶液中通入0.1molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好完全反应
D.反应至4min时,若HCl浓度为0.12mol/L,则0~4min内H2的反应速率为0.03moL/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,1molP4(P原子均达到8电子稳定结构)中所含P-P键数目为4NA
B.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数小于0.2NA
C.20mL10mol/L的浓硝酸与足量铜加热反应转移电子数为0.1NA
D.0.1molNH2-所含电子数为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol Cl2全部作为氧化剂时,失去的电子数为2NA个
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA个
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
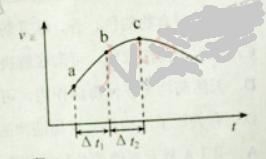
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com