
分析 反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题;
解答 解:①该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价,被氧化,既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为: ;
;
②当有3mol Cl2生成时,转移5mol电子,所以生成标准状况下的Cl2为67.2L即$\frac{67.2L}{22.4mol/L}$=3mol,则转移电子个数为5NA,故答案为:5NA.
点评 本题考查氧化还原反应,为高频考点,把握电子守恒、原子守恒及反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
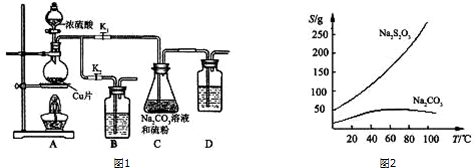
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用溶于水后“过滤”操作能分离NaCl和Ba(OH)2 | |
| B. | 实验结束后,用嘴吹灭酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0% | B. | 14.3% | C. | 19.0% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

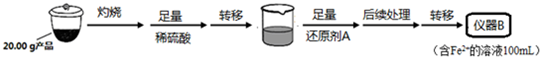
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com