
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
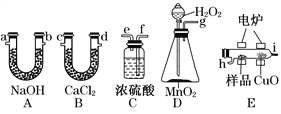
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是__________。
(3)D装置中MnO2的作用是___________。
(4)燃烧管中CuO的作用是_________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为________。
(6)要确定该物质的分子式,还要知道该物质的______,经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①食盐水 ②二氧化碳 ③盐酸 ④蔗糖 ⑤硫酸氢钠固体 ⑥氧气 ⑦纯醋酸 ⑧金属铜 ⑨碳酸氢钠固体。请回答下列问题(用序号填写)
(1)能导电的是________________________,属于电解质的是___________________,属于非电解质的是____________________。
(2)写出相关电解质在水溶液中的电离方程式_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
某同学欲用胆矾晶体配制100 mL 0.1 mol/L的CuSO4溶液,请完善以下实验步骤:
(1)用托盘天平准确称取胆矾晶体________g,将晶体转移至100 mL烧杯中,加适量水溶解,恢复至室温。将烧杯中的溶液转移到______________中,用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,并将洗涤液注入待配制的溶液中;定容;将瓶塞盖好,反复上下颠倒,摇匀。将所配制溶液装入试剂瓶贴标签。
请在相应空格内填入完整信息。
(2)本实验涉及用到的上面空格处的玻璃仪器在使用前应_____________________。请叙述定容操作的具体步骤:________________________________________________
(3)下列实验操作会使配制溶液的物质的量浓度偏低的是_____________
A.转移过程中未洗涤烧杯和玻璃棒
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.配制时,容量瓶有少量蒸馏水
D.定容时俯视刻度线
E.称量过程中将胆矾晶体放在了托盘天平的右侧托盘中(用到了游码)
(4)若通过本实验配制的CuSO4溶液重新获得胆矾晶体,实验操作应为________________
(5)取本实验配制的CuSO4溶液25 mL,通入一定量的氨气(标准状况),可使Cu2+完全沉淀,反应方程式为CuSO4+2NH3+2H2O=Cu(OH)2↓+(NH4)2SO4,则理论上至少应通入_____mL氨气。反应后的溶液中含有一定量的NH4+,请用化学方法检验该离子的存在_________。
(6)Cu(NO3)2也是重要的铜盐,无水硝酸铜固体在试管内加热发生如下反应:2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑。该反应是否属于氧化还原反应____________(填写“是”或“否”)。有同学尝试将带火星的木条伸入试管中,发现木条恢复燃烧,该同学得出的结论是NO2气体支持燃烧,你认为他的结论是否正确_____(填写“是”或“否”),你的理由是________________。
2CuO+4NO2↑+O2↑。该反应是否属于氧化还原反应____________(填写“是”或“否”)。有同学尝试将带火星的木条伸入试管中,发现木条恢复燃烧,该同学得出的结论是NO2气体支持燃烧,你认为他的结论是否正确_____(填写“是”或“否”),你的理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.L层电子比K层电子能量高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的组成为 C15H24,分子结构非常对称。有关实验证明该烃中仅存在三种基团:乙烯基(— CH=CH2),亚甲基(—CH2—)和次甲基( ![]() ),并且乙烯基和次甲基之间必须通过亚甲基相连。当 该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连。当 该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
A. 4、6 B. 2、3 C. 3、3 D. 3、6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香精是由人工合成的模仿水果和天然香料气味的浓缩芳香油,属于人造香料,多用于制造 食品,化妆品和卷烟等.
Ⅰ、苏合香醇是一种食用香精,由 C8H10 合成其路线如图 1 所示.
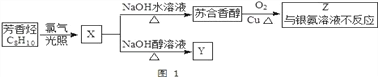
回答 1-2 题:
Ⅱ、有机物 G 也是一种常见香料,其合成路线如图 2.其中 D 的相对分子质量为 88,它的核磁共振 氢谱显示只有三组峰;F 与苏合香醇互为同系物.
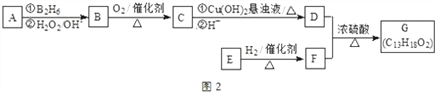
已知:R-CH=CH2 ![]() R-CH2CH2OH
R-CH2CH2OH
回答 3-6 题:
(1)苏合香醇的结构简式为____________,它不能发生的有机反应类型有____________。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤氧化反应 ⑥水解反应
(2)Y 分子中最多有____________个原子共平面。
(3)C 与新制 Cu(OH)2 悬浊液反应的化学方程式为____________。
(4)G 中含有两个甲基,E 可发生银镜反应,在催化剂存在下,1mol E 与 2mol H2 可以反应生成 F, 则 E 的结构简式为____________。
(5)D 与 F 反应的化学方程式为____________。
(6)苯环上有两个取代基,且显弱酸性的 F 的同分异构体共有____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板A、B分成甲、乙两室。标准状况下,在乙室充入8.4g N2,甲室充入8.8g H2和O2的混合气体。
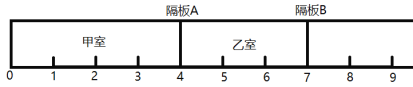
(1)甲室中的原子个数约为 ______________个,H2与O2的质量比为_____________。
(2)维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P(甲):P(乙)=______________。
(3)用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com