
| A. | SO2和SO3都是酸性氧性物,二者的水溶液都是强酸 | |
| B. | 将足量的SO2通入BaCl2溶液中可生成白色沉淀 | |
| C. | 检验SO2中是否含有CO2的方法是通过澄清的石灰水 | |
| D. | 向含有BaCl2和NaOH的混合溶液中通入少量SO2气体,有白色沉淀生成 |
分析 A、SO2和SO3都是酸性氧性物,二氧化硫对应的酸是亚硫酸弱酸;
B、弱酸不能制强酸;
C、二氧化硫和二氧化碳都能使澄清石灰水变浑浊;
D、二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡生成亚硫酸钡.
解答 解:A、SO2和SO3都是酸性氧性物,二氧化硫对应的酸是亚硫酸弱酸,而不是都是强酸,故A错误;
B、弱酸不能制强酸,二氧化硫与氯化钡不反应,故B错误;
C、二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以不能用SO2中是否含有CO2的方法是通过澄清的石灰水,故C错误;
D、二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡生成亚硫酸钡,所以观察有白色沉淀生成,故D正确;
故选D.
点评 本题考查二氧化硫的化学性质,涉及物质的鉴别和转化,题目难度中等,本题注意把握常见物质的性质,根据性质的异同选择实验方案.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g)只有达到限度时才有2v(O2)=v(SO3) | |
| C. | 对于反应2SO2(g)+O2(g)?2SO3(g)达到限度时,增大容器容积能减小正反应速率 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )
2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )| A. | 该过程可以表示为:CO+O$\frac{\underline{\;催化剂\;}}{\;}$C02 | |
| B. | 该过程中有热量放出 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 钌催化剂能改变该反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
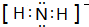 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | FeSO4 | D. | NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com