
(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s)  =-2830kJ·mol-1
=-2830kJ·mol-1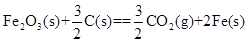
 =+230kJ·mol-1
=+230kJ·mol-1
 =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是 。
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ;
②装置中Cu电极上的电极反应式为 。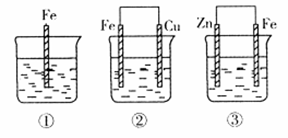
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
(9分)
(1)2Al(s)+Fe2O3(s)= Al 2O3(s)+ 2Fe(s) △H=-600kJ·mol(2分)
(2)②>①>③ O2+2H2O+4e-=4OH-
(3)①VO2-+2H++e-= VO2++ H2O(2分);②绿(1分);紫(1分)
解析试题分析:。
(1)分别标记三个方程式为①式、②式、③式,根据盖斯定律①式-②式×2-③式×3得2Al(s)+Fe2O3(s)= Al 2O3(s)+ 2Fe(s) △H=-600kJ·mol 。
(2)腐蚀速率:电化学腐蚀>化学腐蚀>被保护的腐蚀,所以②>①>③;②装置中Cu电极为正极,O2放电,O2+2H2O+4e-=4OH-。
(3)观察图片,①VO2-(黄色)、 VO2+(蓝色),其电极反应式为VO2-+2H++e-= VO2++ H2O。②充电过程中,右槽的电子,价态降低。
考点:本题盖斯定律、考查电池、电解池等相关知识。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:填空题
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端 (填高、低、不变。下同);当杠杆为导体时,A端比B端 。
(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如下图所示,其中Y为可溶性硫酸盐。

请回答下列问题:
①电解质溶液Y是 ;(填化学式)
②X电极发生的电极反应为 ;
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 填(“原电池”或“电解池”),A中溶液浓度 (填增大、不变、变小),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)
(4)把(2)中盐桥改为铜棒,其它不变,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式:
___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下_______L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为_______。 电池总离子反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学设计了如下图所示的装置进行电化学实验,请你根据装置图回答相关问题: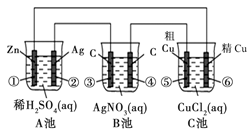
(1)C池属于什么装置 。
(2)电极②上发生电极反应式为 ;B池中发生的总反应方程式为 。
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是________。
(4)当电路上有0.2 mol电子流过时,电极④上质量变化______g, 电极⑥上质量变化______g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行氯化镁溶液龟解实验,电解装置如图所示。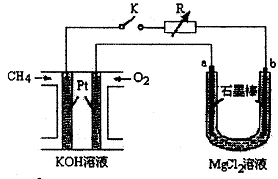
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为: 。
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的气体可用 检验,b电极上得到的气体是 ,电解氯化镁溶液的离子方程式为 。
(3)若甲烷通入量为1.12 L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为 ,产生的氯气体积为 L(标准状况)。
(4)已知常温常压下,0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,请写出CH4燃烧热的热化学方程式 。
已知;①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
计算:C(石墨)与H2(g)反应生成1molCH4(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学地补充碘可防止碘缺乏病。
(1)上图为海带制碘的流程图。步骤③的实验操作中用到的玻璃仪器除了烧杯、玻璃棒之外还有 ;当步骤④反应中转移0.2mol电子时生成碘的质量:
(2)碘酸钾(KIO3)是食盐的加碘剂。KIO3在酸性介质中能与H2O2或I-作用均生成单质碘。
请回答下列问题:
①以碘为原料,通过电解制备碘酸钾的实验装置如图所示。电解前,将一定量的精制碘溶于过量氢氧化钾溶液,溶解是发生反应为:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区。电解时,阳极反应: I-+6OH--6e-=IO3-+3H2O,当外电路上通过3mol电子时(碘离子被完全消耗),溶液中的IO3-的物质的量是 ;阴极上产生的气体在标准状况下的体积: 。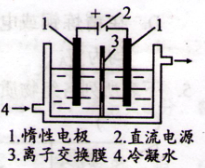
②电解过程中,需通过检验阳极电解液中是否有I-存在以确定电解是否完成。请设计判断电解是否完成的实验方案,并填人下表。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.在下图的装置中,属于原电池的是 。
Ⅱ.(1)如图所示,烧杯中为CuCl2溶液,在图中画出必要的连线或装置,使连接后的装置为原电池。电极反应方程式:
铁板: ;碳棒: 。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,当导线上通过3.01×1022个电子时,锌片质量减少________g。铜片表面析出氢气_________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: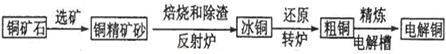
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。
在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com