
【题目】C、N、P、S、Fe、Cu是与人类生产、生活息息相关的化学元素,利用所学知识回答下列问题:
(1)基态Cu原子核外电子排布式为___,则高温下的稳定性CuO___Cu2O(填“>”或“<”);
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,其中C、N的杂化方式分别为___,___;
(3)Si、P、S元素的第一电离能由大到小的顺序是___;
(4)OF2的空间构型是___,分子极性:H2O___OF2(填“>”或“<”),理由是___;
(5)[Fe(CN)6]3-中配位键和π键的个数之比为___;
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是___。
【答案】[Ar]3d104s1或1s22s22p63s23p63d104s1 < sp2 sp3 P>S>Si V形 > 二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱 1:2 邻羟基苯甲醛形成了分子内氢键,而对羟基苯甲醛形成了分子间氢键,故前者沸点低
【解析】
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常;有机物沸点与碳原子个数和氢键有关。
(1)根据核外电子排布规律,铜原子序数为29,基态Cu原子核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;铜的价电子是3d104s1,在高温时,容易失去外层4s1上的一个电子,形成3d10的电子结构,根据洪特规则,轨道全满半满和空的时候能量低,所以高温时1价铜比2价铜稳定,则高温下的稳定性CuO<Cu2O;
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,化合物中C原子含有3个σ键且不含孤电子对,所以其杂化方式为sp2,N原子分别含有3个σ键且含有一个孤电子对,所以N原子采用sp3杂化;
(3)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常,Si、P、S三种元素原子的第一电离能由大到小的顺序是P>S>Si;
(4)由价层电子对互斥理论可知,OF2中中心原子为O,F为配位原子, 价层电子对数=![]() ,成键电子对数为2,孤电子对数为4-2=2,电子对构型为正四面体 ,孤电子对越多,排斥力越大,所以OF2分子构型为V型,分子极性:H2O>OF2,理由是二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱;
,成键电子对数为2,孤电子对数为4-2=2,电子对构型为正四面体 ,孤电子对越多,排斥力越大,所以OF2分子构型为V型,分子极性:H2O>OF2,理由是二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱;
(5)[Fe(CN)6]3-结构中,一个CN-含有1个σ键,2个π键且每次CN-与铁以配位键相结合,配位键和π键的个数之比为1:2;
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是邻羟基苯甲醛形成了分子内氢键,而对羟基苯甲醛形成了分子间氢键,故前者沸点低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
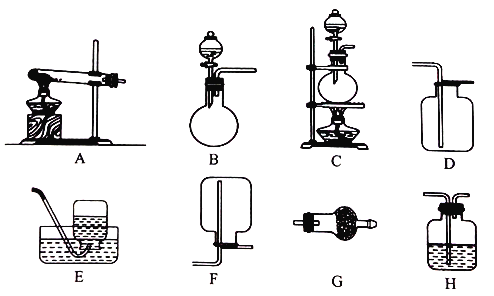
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿挥发油是青蒿的活性成分(几乎不溶于水,可溶于乙醚,熔点156-157℃,对热不稳定,乙醚的沸点34.6℃),有抗菌、解热、止咳等作用。实验室从青蒿中提取青蒿挥发油的流程如图所示。
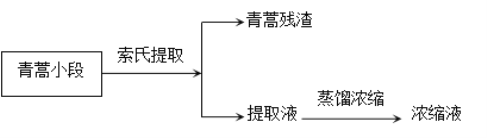
索氏提取装置如图所示,实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与青蒿小段接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿小段的连续萃取。回答下列问题:
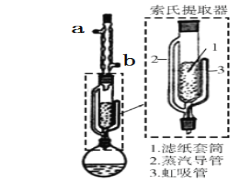
(1)实验时需将青蒿剪成1-2cm小段,放入滤纸套筒1中,剪成小段的目的是___,圆底烧瓶中加入乙醚为溶剂时,应不超过烧瓶容积的___。
(2)索氏提取器中滤纸套筒的高度(x)、套管内青蒿小段的高度(y)及虹吸管的高度(z)由大到小的顺序是___(用x、y、z回答),与常规的萃取相比,采用索氏提取器的优点是___。
(3)提取时球形冷凝管中冷水应从__(填“a”或“b”)管导入,提取液需经___(“常压”或“减压”)蒸馏法除去大部分溶剂,下列仪器在该蒸馏中需要用到的有___(填字母标号)。
A.直形冷凝管 B.球形冷凝管 C.锥形瓶 D.烧杯 E.温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 可消除
可消除![]() 的污染,反应原理为:
的污染,反应原理为:![]() ,在10L密闭容器中分别加入
,在10L密闭容器中分别加入![]() 和
和![]() ,测得不同温度下
,测得不同温度下![]() 随时间变化的有关实验数据如表所示:
随时间变化的有关实验数据如表所示:
组别 | 温度 | 时间 物质的量 | 0 | 10 | 20 | 40 | 50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| M |
|
下列说法正确的是
A.组别![]() 中
中![]() 内,
内,![]() 降解速率为
降解速率为![]()
B.由实验数据可知温度![]()
C.![]() 时,表格中M对应的数据为
时,表格中M对应的数据为![]()
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O
请根据要求填写下列空白:
(1)溶液①呈_________性(填“酸”、“碱”或“中”),其原因是_____________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是____(填序号)。
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3H2O和________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____________c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com