
| A、CO32-+H2O═HCO3-+OH- |
| B、HCO3-+H2O═CO32-+H3O+ |
| C、CO2+H2O═H2CO3 |
| D、H2O+H2O═H3O++OH- |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3含有的Na+离子数为0.01NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、常温常压下,48gO2和O3的混合气体中氧原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO2发生氧化反应 |
| B、NH4Cl中的氮元素被还原 |
| C、N2既是氧化产物,又是还原产物 |
| D、每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
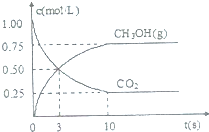 目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+
目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
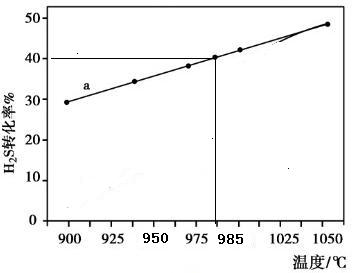
查看答案和解析>>
科目:高中化学 来源: 题型:
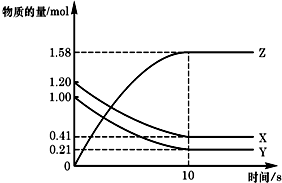 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、应开始到10 s时,Y的转化率为79.0% |
| B、应的化学方程式为:X(g)+Y(g)=Z(g) |
| C、应开始到10 s,用Z表示的反应速率为0.158mol/(L?s) |
| D、开始到10 s,X的物质的量浓度减少了0.79mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com