
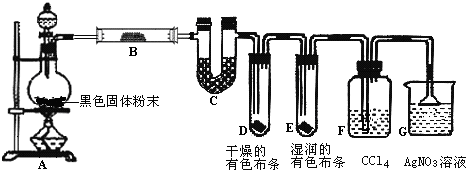
| ||
| △ |
| ||
| △ |
| ||
| △ |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 甲基橙 | 甲 |
| C | 碱 | 酸 | 酚酞 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |

查看答案和解析>>
科目:高中化学 来源: 题型:
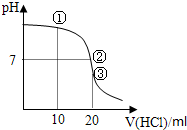
| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

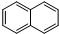 )的衍生物;
)的衍生物;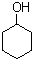 为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
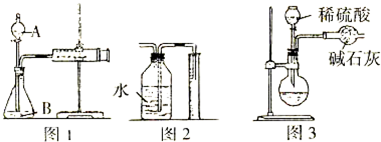
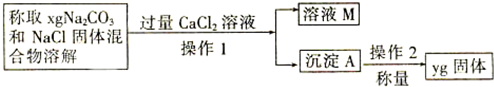
查看答案和解析>>
科目:高中化学 来源: 题型:
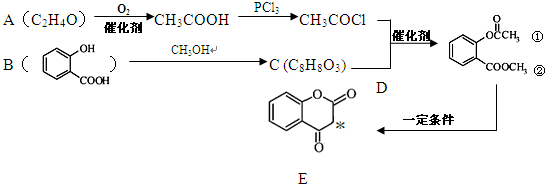
 )是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.
)是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.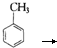
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol/L H2SO4溶液 |
| B、3mol/L CuSO4溶液 |
| C、6mol/L KOH溶液 |
| D、3mol/L Ba(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com