
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
分析 A.D原子含有1个中子、16O含有8个中子;
B.氯化铵为离子化合物;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.先判断非金属元素的非金属性,再判断氢化物的稳定性.
解答 解:A.D216O中D原子含有1个中子、16O含有8个中子,其分子中含有10个中子,故A错误;
B.NH4Cl中含有铵根离子和氯离子,属于离子化合物,故B错误;
C.HCl为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ,故C错误;
,故C错误;
D.非金属性越强,氢化物越稳定,S的非金属性比F弱,所H2S的稳定性比HF弱,故D正确;
故选D.
点评 本题考查原子结构与性质的关系,题目难度不大,涉及原子结构、化合物类型、氢化物稳定性、电子式等知识,注意掌握离子化合物与共价化合物的区别,明确原子构成、电子式的表示方法为解答关键,试题培养了学生的综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂解和蛋白质水解都是由高分子化合物生成小分子物质的过程 | |
| B. | 乙烯分别使溴水和酸性KMnO4溶液褪色,反应原理相同 | |
| C. | C6H14有5种同分异构体 | |
| D. | CH4和Cl2按体积比1:3混合可制得纯净的CHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属间发生置换反应 | |
| B. | 金属元素的最高价氧化物对应水化物的碱性强弱 | |
| C. | 1mol金属单质在反应中失去电子的多少 | |
| D. | 金属元素的单质与水或酸反应置换出氢气的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 理论解释 |
| A | Na 与水反应失去 1 个电子,Mg 与水反应失去 2 个电子 | Na 的金属性比 Mg 强 |
| B | H2S 的还原性比 HCl | S 的非金属性比 Cl |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子 |
| D | Si 是半导体材料,同主族的 Ge 也 是半导体材料 | ⅣA 元素形成的单质都是半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
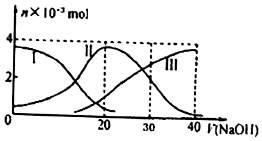
| A. | H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2- | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+ )+c(HA- )+2c(H2A)═c(A2- )+2c(OH-) | |
| D. | 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com