
| A. | 酒精在氧气中燃烧 | B. | 在硫酸中加入铝粉 | ||
| C. | 将二氧化碳气体通入烧碱中 | D. | 向盐酸中加入铁钉 |
分析 A、氧气不足生成一氧化碳,氧气充足生成二氧化碳;
B、硫酸与铝反应生成硫酸铝和氢气;
C、二氧化碳足量生成碳酸氢钠,二氧化碳少量生成碳酸钠;
D、盐酸与铁反应生成氯化亚铁和氢气.
解答 解:A、氧气不足生成一氧化碳,氧气充足生成二氧化碳,产物受反应物的量和浓度的影响,故A错误;
B、硫酸与铝反应生成硫酸铝和氢气,产物不受反应物的量和浓度的影响,故B正确;
C、二氧化碳足量生成碳酸氢钠,二氧化碳少量生成碳酸钠,产物受反应物的量和浓度的影响,故C错误;
D、盐酸与铁反应生成氯化亚铁和氢气,产物不受反应物的量和浓度的影响,故D正确;
故选BD.
点评 本题考查了物质性质的分析应用,反应条件不同,物质浓度不同产物不同,掌握物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 | |
| C. | 电解精炼铜,粗铜中所含Ni、Fe,Zn等杂质,电解后以单质形式沉积槽底 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
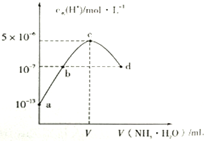 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com