
 科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有
科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有 键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子.
键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子.| 1 |
| 3 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
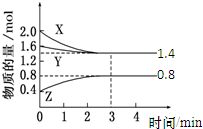 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.2 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3X(g)+Y(g)?2Z(g) |
| C、保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D、温度不变,增大X的浓度,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度/mol/L 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| 温度/℃ | 25 | T1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、SO42-、Cl- |
| B、Ca2+、HCO3-、NO3-、SO42- |
| C、K+、NO3-、SO42-、CO32- |
| D、Mg2+、SO42-、CO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com