
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
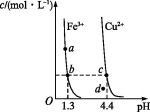
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
C.加适量NH4Cl固体可使溶液由a点变到b点
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年海南省高二上期中文化学卷(解析版) 题型:选择题
下列物质既可以做防腐剂,又可以做调味剂的是()
A、食盐 B、苯甲酸钠 C、柠檬黄 D、味精
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考文化学卷(解析版) 题型:选择题
我国古代就有湿法炼铜的记 载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是
载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是
A.Fe是氧化剂 B.CuSO4是还原剂
C.Fe被氧化 D.CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:填空题
(1)①在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液至pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,若溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
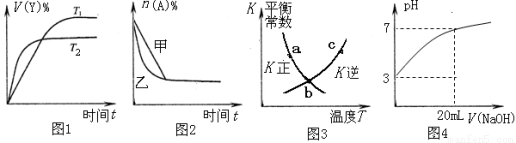
A.图1表示可逆反应“2X(g)  Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH =3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学卷(解析版) 题型:选择题
按下列实验方法操作,能达到要求的是
A. 用托盘天平称量25.20g氯化钠固体
B. 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片防止暴沸
C. 加热饱和FeCl2溶液制备Fe(OH)3胶体
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:实验题
用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4﹣转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的
| 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
① | 常温 | 1 | 20 | 50 | 30[ | t1 |
② | 常温 | 2 | 20 | 50 | 30 | t2 |
③ | 常温 | 2 | 40 | a | b | t3 |
表中a、b的值分别为:a= 、b=
(2)该反应的离子方程式 。
(3)若t1<t2,则根据实验①和②得到的结论是 。
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容.
实验方案(不 | 预期实验结果和结论 |
若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
(5)某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O4•2H2O,其摩尔质量126 g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液V mL.请回答下列问题:
① 该测定方法中 (填“需要”或“不需要”)加入指示剂;
② 计算得KMnO4溶液的c(KMnO4)= mol/L.(请写出最后化简结果)
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:选择题
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中 的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH 下列说法正确的是( )
的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH 下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.NiMH电池可以是硫酸溶液作为电解质溶液
D.NiMH电池电子由负极→正极→电解质溶液→负极,形成闭合回路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com