
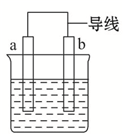
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

科目:高中化学 来源: 题型:
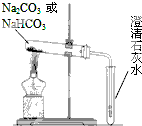 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
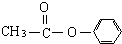 、
、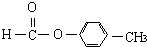 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
n- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图Ⅰ所示装置用于实验室制取氨气 |
| B、图Ⅱ所示装置用于制备少量氢气 |
| C、图Ⅲ所示装置用于测定中和反应的反应热. |
| D、图IV所示装置用于证明非金属性强弱S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
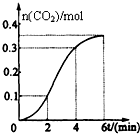
| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医学上用于消毒的酒精是75%酒精溶液 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、食醋是含3%~5%乙酸的溶液 |
| D、乙醇可做为提取碘水中碘的萃取剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com