
| A. | ①②⑤ | B. | ①⑥⑧ | C. | ①③ | D. | ③④ |
分析 ①氩气为单原子单质;
②H2O2是共价化合物,无阴离子;
③氧气和臭氧分子均由氧原子构成;
④铁有+2价和+3价;
⑤标准状况下,11.2LCl2的物质的量为0.5mol,而和水的反应为可逆反应;
⑥在O2参与的反应中,氧元素可能变为-1价或-2价;
⑦求出NH4NO3的物质的量,然后根据1mol硝酸铵中含2mol氮原子来分析;
⑧标准状况下,CCl4为液态.
解答 解:①氩气为单原子单质,故含NA个氩原子的氩气的物质的量为1mol,在标况下的体积为22.4L,故正确;
②H2O2是共价化合物,结构中无阴离子,故错误;
③氧气和臭氧分子均由氧原子构成,故21g氧气和27g臭氧的混合物即48g混合物中含有的氧原子的物质的量为3mol,个数为3NA个,故正确;
④铁有+2价和+3价,故1mol铁参与反应后失去的电子数可能为2NA个,也可能为3NA个,故错误;
⑤标准状况下,11.2LCl2的物质的量为0.5mol,而和水的反应为可逆反应,故转移的电子数小于0.5NA个,故错误;
⑥在O2参与的反应中,氧元素可能变为-1价或-2价,故1mol氧气转移的电子数可能为2NA个,也可能为4NA个,故错误;
⑦溶液中NH4NO3的物质的量为n=CV=1mol/L×1L=1mol,1mol硝酸铵中含2mol氮原子,即2NA个,故错误;
⑧标准状况下,CCl4为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、OH-、NO3- | B. | Ba2+、Na+、SO42-、OH- | ||
| C. | H+、K+、HCO3-、Cl- | D. | K+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K+、Cu2+、NO3-、AlO2- | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br - | |
| D. | 各离子物质的量浓度相等的溶液:K+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBr的电子式: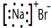 | B. | Na218O 中阴离子的结构示意图: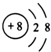 | ||
| C. | CH4的结构式: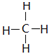 | D. | HF的电离方程式:HF?F-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ka(H2CO3)<Ka(CH3COOH)说明相同物质的量浓度时,碳酸的酸性比醋酸的强 | |
| B. | 一般情况下,当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大 | |
| C. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明某溶液中一定含有Fe2+,一定不含有Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com