
 2SO3(g);△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g);△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%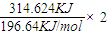 =3.2mol,则SO2的转化率为
=3.2mol,则SO2的转化率为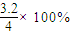 80%,故B正确;
80%,故B正确;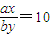 ,所以有:x>10y,等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为Va和Vb,则有xVa=yVb,则Vb>10Va,故D错误.
,所以有:x>10y,等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为Va和Vb,则有xVa=yVb,则Vb>10Va,故D错误.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
 .下列有关叙述正确的是( )
.下列有关叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com