
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 ⑦  (在横线上填相应的序号)
(在横线上填相应的序号)
A、互为同位素的是; B、互为同分异构体的是;
C、互为同素异形体的是; D、同一种物质的是 .
【答案】③;④⑥;①;②⑦
【解析】解:①O2和O3 是同种元素所形成的性质不同的单质,互为同素异形体;②H2、D2、T2 都是氢元素组成的,是属于同种物质;③12 C和14 C 中子数不同,是碳元素的不同原子,互为同位素;④CH3CH2CH2CH3和(CH3)2CHCH3 分子式相同,结构不同,为碳链异构,互为同分异构体;⑤癸烷和十六烷 结构相似,都属于烷烃,分子组成上相差6个CH2原子团;⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 分子式相同,结构不同,为碳链异构,互为同分异构体;⑦ 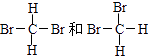 都是甲烷的二溴代物,属于同种物质.A、互为同位素故选③;B、互为同分异构体故选④⑥;C、互为同素异形体故选①;D、同一种物质故选②⑦.答案:A.③;B.④⑥;C.①;D.②⑦.
都是甲烷的二溴代物,属于同种物质.A、互为同位素故选③;B、互为同分异构体故选④⑥;C、互为同素异形体故选①;D、同一种物质故选②⑦.答案:A.③;B.④⑥;C.①;D.②⑦.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 阿伏伽德罗常数是6.02×1023 B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 0.1 mol CH4所含氢原子数为0.4NA D. 常温常压下,28 g N2中所含原子个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应2NO2(g) ![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是
A. 实验2使用了比实验1效率更高的催化剂
B. 实验2的反应容器体积比实验1的小
C. 通过实验2和实验3可判断该反应是放热反应
D. 实验2的平衡常数比实验3的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+Y(g)nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01molL﹣1min﹣1 , 则 n是( )
A.2
B.4
C.1
D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。

①实验前需进行的操作是 .稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。方案I中过氧化镁的质量分数为 (用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为 (用含V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2![]() Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3
Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3![]() Si3N4+12HCl。则下列叙述正确的是
Si3N4+12HCl。则下列叙述正确的是
A. 反应②属于离子反应
B. 若制取等量的Si3N4,则反应①②转移电子数目必然相等
C. 反应①的氧化剂是N2
D. 反应①中氧化产物与还原产物物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的电子式为 , 碳氢键之间键角为 . 甲烷和氯气在光照下发生取代反应,生成种产物.产物中常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g)![]() 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____(填“加快”“减慢”“无影响”), 理由是_______________________________________________________________.
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______.(填“加快”“减慢”“无影响”) 理由是________________________________________________.
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____.(填“加快”“减慢”“无影响”) 理由是_____________________________________________.
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______.(填“加快”“减慢”“无影响”) 理由是____________________________________________.
(5)提高起始的反应温度,反应速率______.(填“加快”“减慢”“无影响”) 理由是_________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com