
下列叙述中正确的是( )
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g) + B(g)=3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
制备氮化镁的装置示意图如下:
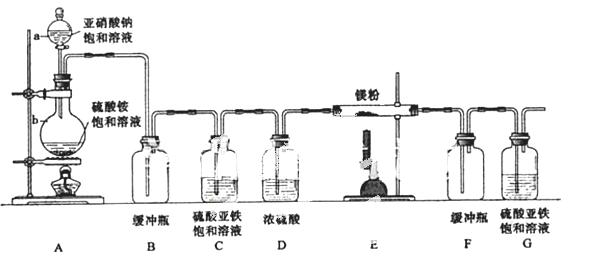
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
验证周期表中同一周期内从左到右元素的性质的变化规律和同一主族内从上到下的元素性质变化规律: 从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中(答错扣1分)。
| 实验方法(Ⅰ) | 实验现象(Ⅱ) | |||||||||
| A.钠与冷水反应 | a.溶液分层,下层变为橙色 | |||||||||
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 | |||||||||
| C.将H2S溶液中通入氯气 | c.反应不十分剧烈,产生的气体能燃烧 | |||||||||
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 | |||||||||
| E.NaI溶液中加入溴水,再加入CCl4 | e.生成白色胶状沉淀,后又溶解 | |||||||||
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 | |||||||||
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 | |||||||||
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 | |||||||||
| I.镁带空气中燃烧 | i.溶液出现淡黄色沉淀 | |||||||||
| J.NaBr溶液中加入氯水,再加入CCl4 | j.观察不出什么现象 | |||||||||
| K.铝片与2mnol/L盐酸反应 | k. 溶液分层,下层变为紫色 | |||||||||
| 同周期 | ||||||||||
| Ⅰ | ||||||||||
| Ⅱ | ||||||||||
| 同主族 | ||||||||||
| Ⅰ | ||||||||||
| Ⅱ | ||||||||||
解释在同一周期内从左到右金属性逐渐减弱的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
F1 F2 F3 G4 H3【2014·宁夏银川一中三模】(14分)
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中:
2c(H+) + c(CH3COOH) = 2 c(OH-) + c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各小题
(1)按系统命名法,化合物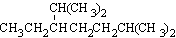 的名称是____________________。
的名称是____________________。
(2)蛋白质是构成生命的基础物质,而氨基酸又是构成蛋白质的基石,最简单的氨基酸其
结构简式是 ;该氨基酸形成的二肽的结构简式是 ;将该氨基酸溶于酸性溶液形成的微粒的结构简式是 ;将该氨基酸溶于碱性溶液形成的微粒的结构简式是 ;固态氨基酸主要以内盐形式存在,该氨基酸的内盐的结构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com