
| A. | 加水稀释,平衡左移,溶液颜色变浅 | |
| B. | 加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅 | |
| C. | 加入一定量的铁粉,充分振荡后,溶液颜色变浅 | |
| D. | 加入少量的KCl固体,平衡左移,溶液颜色变浅 |
分析 A.结合平衡常数分析,加水稀释,离子浓度降低,反应物浓度系数次幂的乘积降低更多;
B.Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低;
C.加入一定量的铁粉,铁与铁离子反应,溶液中Fe3+浓度降低;
D.根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答 解:A.加水稀释,离子浓度降低,溶液颜色变浅,c3(SCN-)•c(Fe3+)降低更多,平衡左移,故A正确;
B.Fe3+与OH-生成Fe(OH)3红褐色沉淀,导致Fe3+浓度降低,平衡向左移动,溶液颜色变浅,故B正确;
C.加入一定量的铁粉,铁与铁离子反应,溶液中Fe3+浓度降低,平衡向左移动,溶液颜色变浅,故C正确;
D.加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动,溶液颜色不变,故D错误;
故选D.
点评 本题考查学生对平衡移动原理的理解,比较基础,注意平衡的建立是铁离子、硫氰根离子和硫氰化铁,和氯离子、钾离子浓度变化无关,根据平衡常数理解平衡移动.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
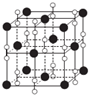 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
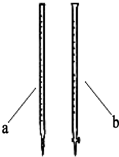 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附着油污的晶体管可用碱液浸泡 | B. | 光导纤维遇碱会影响光信号传输 | ||
| C. | 工业上用S iO2热分解法冶炼硅 | D. | 自然界中硅以游离态形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
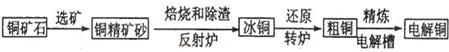
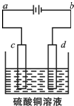
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O是还原剂 | B. | Fe被氧化 | C. | H2O发生氧化反应 | D. | Fe得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH<7:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| B. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH) | |
| C. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com