
| A. | 用饱和NaHCO3溶液除CO2中的氯化氢气体 | |
| B. | SO2与乙烯的混合气体依次通入酸性高锰酸钾溶液、浓硫酸洗气后可得到纯净的SO2 | |
| C. | 用酒精萃取碘水中的碘单质 | |
| D. | 用CaO干燥Cl2 |
分析 A.除杂时要除去杂质且不引进新的杂质;
B.乙烯和SO2都能被酸性高锰酸钾溶液氧化,且乙烯被氧化后生成CO2;
C.萃取剂和原溶剂不能互溶;
D.CaO和水反应生成氢氧化钙,氢氧化钙能和氯气反应.
解答 解:A.HCl和NaHCO3反应生成CO2,且CO2和NaHCO3不反应,所以可以用饱和NaHCO3溶液除CO2中的氯化氢气体,故A正确;
B.乙烯和SO2都能被酸性高锰酸钾溶液氧化,且乙烯被氧化后生成CO2,所以不能用酸性高锰酸钾溶液除去二氧化硫中的乙烯,故B错误;
C.酒精和水互溶,所以不能用酒精萃取碘水中的碘,应该用四氯化碳或苯,故C错误;
D.CaO和水反应生成氢氧化钙,氢氧化钙能和氯气反应生成氯化钙和次氯酸钙,所以不能用CaO作氯气的干燥剂,可以用浓硫酸作其干燥剂,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查物质分离和提纯、气体干燥,除杂时要除去杂质且不能引进新的杂质,且除杂剂不能和被提纯物质反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
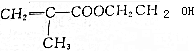 ,下列说法错误的是( )
,下列说法错误的是( )| A. | M能发生加成反应 | |
| B. | M能发生取代反应 | |
| C. | 一定条件下,M能与乙醇发生酯化反应 | |
| D. | M既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现.
现.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1FeCl3溶液中:K+、Na+、AlO2-、SCN- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO${\;}_{{3}_{\;}^{\;}}^{-}$ | |
| C. | 澄清透明的溶液中:Cu2+、Mg2+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 由水电离得到的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com