
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
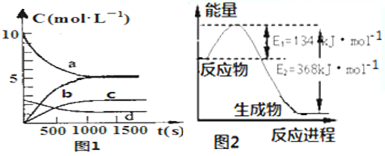
分析 (1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热;
②NO2转化率为已转化的NO2物质的量与起始物质的量的百分比;增大NO2的转化率,促进反应的正向移动即可;
③N2O5为生成物且反应为可逆反应,反应不可能进行到底,以此判断表示N2O5的浓度的变化曲线;
(2)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,结合热化学方程式的书写规则书写;利用写出的热化学方程式,结合给出的热化学方程式,利用盖斯定律,获得答案;
解答 解:(1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$;温度低,化学平衡常数大,则正反应放热,
故答案为:$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$,放热;
②转化的NO2的物质的量为20mol-10.08mol=9.92mol,转化率为$\frac{9.92mol}{20mol}$=49.6%;
A、再充入NO2,转化的物质的量增大,但是起始的物质的量增大较多,转化率降低,故A错误;
B、加入气体比例与原平衡NO2的转化率相同,由于加入气体后,体系压强增大,NO2的转化率增大,故B正确;
C、该反应为放热反应,降低温度,化学平衡向右移动,故C正确;
D、反应气体浓度不变,化学平衡不移动,故D错误;
故选BC;
③N2O5为生成物浓度增大,反应为可逆反应,不可能进行到底,即N2O5的浓度不可能达到5mol/L,故选c;
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:①NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;②2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=-760.3kJ•mol-1,反应①×2-②,可得到:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
故答案为:+292.3kJ•mol-1.
点评 本题考查化学平衡影响因素、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径,中注意从正、逆不同方向建立的等效平衡转化率、反应热的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、NO3-、ALO2- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 测0.1mol•L-1氨水的pH为11,是因为NH2•H2O?NH4++OH- | |
| C. | 0.01mol•L-1NaHCO3溶液中溶质的电离方程式为Na++H++CO32- | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于7 | B. | 等于7 | ||
| C. | 大于7 | D. | 可能等于7,也可能于小于7或大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的甲烷在空气中燃烧可看到黄色火焰,用涂有澄清石灰水的小烧杯照在火焰上方,烧杯内壁变浑浊 | |
| B. | 检测孙老师是否酒后驾车,交警同志可用装有K2Cr2O7酸性试剂的吹气检测仪检测,看到检测仪由橙色变为绿色,说明孙老师酒后驾车应当进行处罚 | |
| C. | 科学探究:小米在家用食醋浸泡鸡蛋,观察到鸡蛋壳表面没有产生气泡,说明食醋主要成分乙酸没有酸性 | |
| D. | 天然纤维,人造纤维,合成纤维中均含有纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
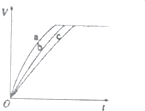 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com