
 pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是
pC(g)反应平衡时,测得c(A)为0.5 mol·L-1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol·L-1,则下列判断中正确的是 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

 = mol/(L·min)
= mol/(L·min)| A.升高温度 | B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )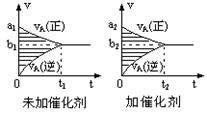
| A.b1>b2 t1>t2 | B.b1<b2t1<t2 |
| C.两图中阴影部分面积相等 | D.图II中阴影部分面积更大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )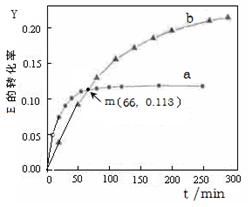
| A.该反应的?H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有: ?n (E, 20℃) = ?n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.高温、高压 | B.适宜温度、高压、催化剂 |
| C.低温、低压、不断分离出甲醇 | D.低温、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为 | A.4mol 35% | B.2mol 30% | C.2mol 70% | D.1mol 15% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: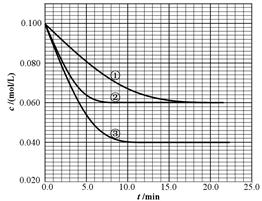
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
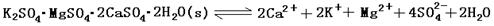
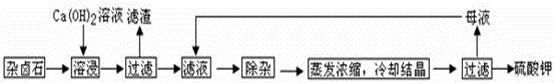
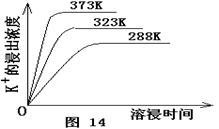

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com