
| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
分析 元素的金属性和非金属性、元素的原子半径都属于元素的性质;元素的相对原子质量递增,但不呈现周期性的变化;结构决定性质,元素原子的核外电子排布的周期性变化导致元素性质的周期性变化.
解答 解:A、元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、元素的原子半径属于元素的性质,原子半径周期性变化是原子的电子排布周期性变化的结果,故B错误;
C、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故C正确;
D、元素金属性或非金属性都属于元素的性质,元素的金属性和非金属性的周期性变化是原子的电子排布周期性变化的结果,故D错误;
故选C.
点评 理解元素周期律的实质,元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果.


科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 用Pt电极电解饱和氯化镁溶液:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
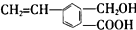 ,关于M的说法正确的是( )
,关于M的说法正确的是( )| A. | M中只有两种官能团 | |
| B. | 1 molM最多能消耗2 mol NaOH | |
| C. | M能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 | |
| D. | M可以发生酯化、加成反应,不能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
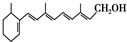 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H30O | |
| B. | 维生素A中含有苯环 | |
| C. | 维生素A中可以使溴水褪色 | |
| D. | 1mol维生素A在催化剂作用下最多可与7molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
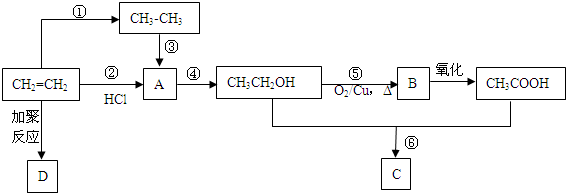
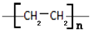 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇 | B. | 甲醇和乙醛 | C. | 丁烷和乙酸乙酯 | D. | 葡萄糖和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
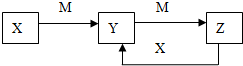 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com