
分析 (1)根据抗酸药物有效成分能中和胃里过多的盐酸,根据化学方程式改写离子方程式;
(2)当人体缺乏维生素A时,就会患夜盲症;牙龈出血是缺乏维生素C造成的;
(3)铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化;
(4)CaCO3与足量盐酸反应生成氯化钙、二氧化碳和水,据此写出化学方程式;
设一片药片中的碳酸钙的质量为xg,根据化学方程式来计算.
解答 解:(1)抗酸药物中的成份与胃酸会发生反应,消耗胃酸,NaHCO3、Al(OH)3与胃酸(以HCl表示)作用的化学方程式:
NaHCO3+HCl=NaCl+H2O+CO2↑;Al(OH)3+3HCl=AlCl3+3H2O;
故离子方程式为:HCO3-+H+=CO2↑+H2O; Al(OH)3+3H+=Al3++3H2O,
故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑;Al(OH)3+3HCl=AlCl3+3H2O;HCO3-+H+=CO2↑+H2O; Al(OH)3+3H+=Al3++3H2O;
(2)到了傍晚就看不见东西,这是夜盲症的重要表现,当人体缺乏维生素A时,就会患夜盲症.
牙龈出血是缺乏维生素C造成的,维生素C主要含在水果和蔬菜中,故答案为:A;C;
(3)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,故答案为:铝与空气中的氧气反应生成一层致密的氧化铝薄膜,隔绝空气;
(4)CaCO3与足量盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
设一片药片中CaCO3的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 22.4L
xg 0.0224L
$\frac{100g}{xg}=\frac{22.4L}{0.0224L}$
解得x=0.1g,
故答案为:0.1.
点评 本题考查药物的主要成分和疗效以及有关化学方程式的计算,侧重于人体健康等化学与生活、生产的关系的考查,题目难度不大,注意把握相关基础知识.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| B. | Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | Fe+4HNO3(稀)═Fe(NO3)2+2NO2↑+2H2O | |
| D. | 2Fe2++4Br-+3Cl2(少量)═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| B. | 在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 聚合物 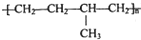 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | +69.4 kJ•mol-1 | D. | -69.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 28 g氮气所含原子数目为NA | |
| D. | 在标准状况下,0.5 NA个氯气分子所占的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
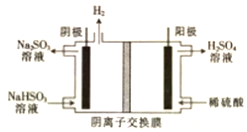 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com