
| A、氯气与水的反应:Cl2+H2O═Cl-+ClO-+2H+ |
| B、Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
| C、足量NaHCO3溶液中加少量澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
| D、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |


科目:高中化学 来源: 题型:
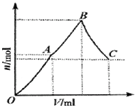 向100mL 3mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol?L-1 Ba(OH)2溶液.
向100mL 3mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol?L-1 Ba(OH)2溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
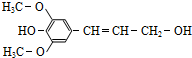 木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇只含有两种官能团 |
| B、芥子醇和苯酚能与溴水发生同样的取代反应 |
| C、芥子醇能与FeCl3溶液发生显色反应 |
| D、芥子醇还能发生的反应类型有氧化、加成、加聚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P是氧化剂 |
| B、CuSO4既不是氧化剂也不是还原剂 |
| C、当反应中有3mol电子转移时,消耗P的质量为34.1g |
| D、被氧化的P原子与被还原的P原子个数比5:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③②④ | B、①③④② |
| C、①③②⑤ | D、①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、② | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| +O2 |
| +O2 |
| +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com