
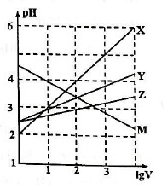
 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下PH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol•L-1的NaA和HA的混合溶液的PH>7,则c(A-)>c(HA) |
分析 已知:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,据此分析,
A.加水稀释相同的倍数时,酸溶液PH增大,pH变化小的是HB;
B.酸性:H2CO3>HA>HCO3->HB,酸性越弱对应阴离子水解程度越大,减小越强;
C.0.1mol/L的NaA和NaB两种盐溶液各1L,水解程度A-<B-,分析比值;
D.若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,溶液显碱性说明A-离子水解程度大于HA电离程度.
解答 解:已知:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,所以加水稀释相同的倍数时,pH变化小的是HB,由图可知,Z为HB,Y为HA,
A.加水稀释相同的倍数时,酸溶液PH增大,pH变化小的是HB,Z为HB,故A错误;
B.酸性:H2CO3>HA>HCO3->HB,酸性越弱对应阴离子水解程度越大,减小越强,常温下pH:NaA溶液<NaB溶液,故B错误;
C.0.1mol/L的NaA和NaB两种盐溶液各1L,水解程度A-<B-,B-离子减少的多,则$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$一定存在HA>HB,故C正确;
D.若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,溶液显碱性说明A-离子水解程度大于HA电离程度,则c(A-)<c(HA),故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、盐类水解原理的应用、影响平衡的因素分析判断.掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Zn、Al | B. | Fe、Zn | C. | Al、Mg | D. | Mg、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
| A. | α1+α2=1;φ2=φ1 | B. | φ3=2φ1;Q3=2Q1 | C. | φ3=φ1=φ2;Q3=2Q1 | D. | α1=α3;Q1+Q2=Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.12 g | B. | 4.24 g | C. | 3.18 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.1mol | ||
| C. | 小于0.1mol | D. | 大于0.1mol,小于0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每当固体质量减轻5.6g时,生成2.8g Si | |
| B. | 氧化剂和还原剂的物质的量之比为1:2 | |
| C. | 硅单质在常温下不与任何酸、碱反应 | |
| D. | 单质硅与单质碳均具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| B. | 用BaCl2溶液鉴别Na2CO3溶液与Na2SO4溶液 | |
| C. | 用加热、称重的方法鉴别NaCl固体和Ca(HCO3)2固体 | |
| D. | 检验某溶液中是否含有H+时,可滴入少量的酚酞试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com