
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
分析 (1)1个H2C2O4中有2个+3价的C,被高锰酸钾氧化到+4价,化合价上升2价,转移2个电子,所以0.1molH2C2O4反应,转移的电子的物质的量为0.2mol;Mn元素的化合价降低,C元素的化合价升高,由电子守恒确定物质的量比;
(2)高锰酸钾为紫色,利用褪色时间比较反应速率,控制高锰酸钾浓度相同,则草酸应过量;
(3)研究催化剂对化学反应速率的影响,浓度、温度应相同;
(4)实验Ⅰ和Ⅳ,氢离子浓度不同.
解答 解:(1)1个H2C2O4中有2个+3价的C,被高锰酸钾氧化到+4价,化合价上升2价,转移2个电子,所以0.1molH2C2O4反应,转移的电子的物质的量为0.2mol;Mn元素的化合价降低,C元素化合价升高,由电子守恒确定物质的量比;Mn元素的化合价降低,C元素的化合价升高,由电子守恒可知,氧化剂与还原剂的物质的量比为$\frac{2×(4-3)}{(7-2)}$=2:5,
故答案为:0.2mol;2:5;
(2)高锰酸钾为紫色,利用褪色时间比较反应速率,即相同浓度的高锰酸钾溶液完全褪色的时间比较反应快慢;控制高锰酸钾浓度相同,保证其完全反应,则草酸应过量,故答案为:高锰酸钾溶液完全褪色的时间;过量;
(3)实验I和II浓度、温度应相同,II用了催化剂,所以实验I和II是研究催化剂对化学反应速率的影响,
故答案为:催化剂;
(4)实验Ⅰ和Ⅳ,氢离子浓度不同,可研究H+的浓度(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ加入1.0mL蒸馏水的目的是确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同,
故答案为:H+的浓度(或硫酸溶液的浓度);确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同.
点评 本题考查氧化还原反应和反应速率影响因素的实验,为高频考点,把握氧化还原反应中电子守恒及控制变量法测定反应速率为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
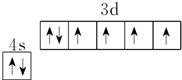 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
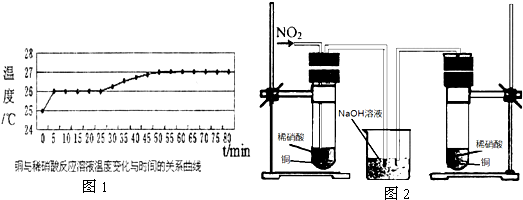
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
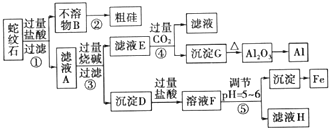
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.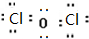 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com