
【题目】海水中溴元素以Br形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
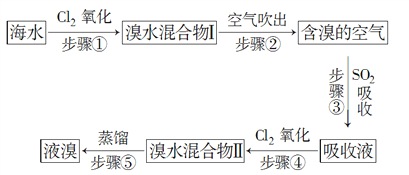
(1)步骤①反应的离子方程式是____________________,步骤③反应的化学方程式是___________________。
(2)从理论上考虑,下列物质也能吸收Br2的是___________(填字母)。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。
【答案】 2Br+Cl2===Br2+2Cl SO2+Br2+2H2O===H2SO4+2HBr ABC Br2 1 Cl2>Br2>SO2
【解析】(1)步骤①发生氯气氧化溴离子,反应的离子方程式是2Br-+Cl2=Br2+2Cl-,步骤③发生溴氧化二氧化硫,反应的化学方程式是SO2+Br2+2H2O=H2SO4+2HBr。(2)A.NaOH能与单质溴反应,A正确;B.FeCl2能被溴氧化,B正确;C.Na2SO3能被溴氧化,C正确;D.溴在水中的溶解性较小,不能用水吸收溴,D错误,答案选ABC;(3)步骤③中反应的化学方程式是SO2+Br2+2H2O=H2SO4+2HBr,其中Br元素化合价降低,氧化剂是Br2,若反应中生成2 mol HBr,则消耗1mol SO2。(4)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是Cl2>Br2>SO2。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.A原子的最外层电子比B原子的最外层电子少2个,B原子的质子数是其电子层数的4倍.A、B、C三种元素能结合成化合物C2AB3,在lmolC2AB3中共有52mol电子。D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移。E元素的单质是一种黄绿色气体,水溶液具有漂白性。试填写下列空白:
(l)写出元素A 和E 的名称:A , E 。
(2)元素B在周期表中的位置为第二周期 族.
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有 键(填“极性”或“非极性”)的 化合物(填“离子”或“共价”) ,写出该化合物的电子式 。
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3).现将0.1molL﹣1次氯酸溶液与0.1molL﹣1碳酸钠溶液等体积混合,在所得混合溶液中各种粒子浓度关系正确的是( )
A.c(Na+)>c(ClO﹣)>c(HCO ![]() )>c(H+)
)>c(H+)
B.c(Na+)>c(HCO ![]() )>c(C1O﹣)>c(OH﹣)
)>c(C1O﹣)>c(OH﹣)
C.c(HClO)+c(C1O﹣)=c(HCO ![]() )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO ![]() )+c(ClO﹣)+c(OH﹣)+c(CO
)+c(ClO﹣)+c(OH﹣)+c(CO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是其次外层电子数的一半。

请回答下列问题:
(1)R的元素名称是_______,中子数为8的X元素的原子是______(用原子组成符号表示)。
(2)上述六种元素,非金属性最强的元素为________________(填元素符号)
(3)Z的最高价氧化物对应水化物的化学式为____________________。
(4)W和Y形成一种二元化合物甲的相对分子质量为184,且Y的质量分数约为30%。则化合物甲的化学式为__________________。化合物甲在摩擦时会发生猛烈爆炸,分解为一种W的单质和一种Y的单质,其中W的单质与Y的单质的相对分子质量之比为64∶7。写出化合物甲爆炸分解的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2L物质的量浓度为0.5molL﹣1KOH溶液含有( )
A.0.5mol的K+
B.0.5mol的H+
C.1.0mol的H+
D.1.0mol的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH﹣、Cl﹣、CO32﹣、NO3﹣、SO42﹣
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
请回答下列问题:
(1)写出A与D的化学式:A , D .
(2)写出A与E溶液反应的离子方程式: .
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=﹣akJmol﹣1 . 请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式: .
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是;将C与醋酸混合,醋酸的电离程度将(填“增大”“不变”或“减小”).
(5)用惰性电极电解0.1molL﹣1 D与0.1molL﹣1C各100mL混合后的溶液,电解一段时间后,阴极质量(填“增大”“不变”或“减小”,下同);溶液的pH .
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子检验的操作和实验结论正确的是( )
A.向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH ![]()
B.向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO ![]()
C.向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com