
| A、砷在通常状况下为固体 |
| B、砷的最高正化合价为+5 |
| C、砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D、砷化氢(AsH3)比氨气(NH3)不稳定 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实际应称NaOH质量 | 应选用容量瓶的规格 | 实验中的所需仪器 |
| ① | ② | 不需填写 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
| c(Pb2+) |
| c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m-n=b-a |
| B、元素原子序数a>b>c>d |
| C、元素非金属性:R>Z |
| D、最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用A表示的反应速率是0.8 mol?L-1?s-1 |
| B、分别用B、C、D表示反应的速率,其比值是3:2:1 |
| C、在2 min末时的反应速率,用反应物B来表示是0.3 mol?L-1?min-1 |
| D、在这2 min内用B和C表示的反应速率的值都是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Cu2+、NO3-、Na+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Na+、Ca2+、Cl-、CO32- |
| D、K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
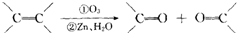 ,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX
,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX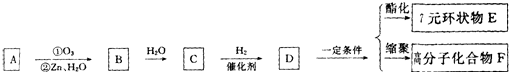
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com