
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
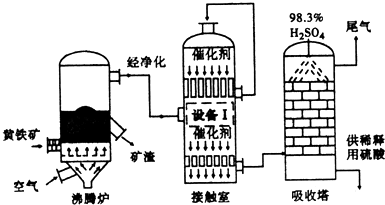
分析 (1)黄铁矿在沸腾炉中氧化生成二氧化硫和氧化铁;
(2)为了充分利用能量,应安装热交换器;
(3)设混合气体的物质的量为100mol,则二氧化硫物质的量为6mol,依据表中数据可知二氧化硫平衡时的含量为0.51%,设反应中消耗的二氧化硫为x,依据方程式:2SO2+O2?2SO3,气体的物质的量减少0.5xmol,反应后的气体的物质的量为100-0.5x,依据二氧化硫平衡时的含量为0.51%计算x,再计算二氧化硫的转化率;
(4)在吸收塔中用水吸收三氧化硫,反应放热易形成酸雾阻止对三氧化硫的吸收;浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(5)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,氨水过量,如果生成NH4HSO3,它将与碳酸氢铵反应,因为亚硫酸的酸性比碳酸强,依据强酸制备弱酸规律,二者反应生成亚硫酸铵,结合其相对分子质量判断化学式;
(6)KMnO4溶液、稀H2SO4 能氧化二氧化硫,且紫色的KMnO4溶液褪色,碘与二氧化硫发生氧化还原反应,淀粉遇碘显蓝色,以此来解答.
解答 解:(1)黄铁矿在沸腾炉中氧化生成二氧化硫和氧化铁,反应的化学方程式:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)为了充分利用能量,应安装热交换器;
故答案为:热交换器;
(3)设混合气体的物质的量为100mol,则二氧化硫物质的量为6mol,依据表中数据可知二氧化硫平衡时的含量为0.51%,设反应中消耗的二氧化硫为x,依据方程式:2SO2+O2?2SO3,气体的物质的量减少0.5xmol,反应后的气体的物质的量为100-0.5x,依据二氧化硫平衡时的含量为0.51%得:$\frac{6-x}{100-0.5x}$=0.0051,解得x=5.5,则二氧化硫的转化率为:$\frac{5.5mol}{6mol}$×100%=91.7%;
故答案为:91.7%;
(4)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒98.3%的硫酸作吸收液,最终得到“发烟”硫酸;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
故答案为:防止形成酸雾;增加SO3与浓硫酸的接触面,有利于SO3的吸收;
(5)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,氨水过量,如果生成NH4HSO3,它将与碳酸氢铵反应,因为亚硫酸的酸性比碳酸强.故该结晶水合物为(NH4)2SO3带若干结晶水,(NH4)2SO3的式量为116.已知该结晶水合物的相对分子质量为134.
故答案为:(NH4)2SO3•H2O;
(6)A.二氧化硫、SO3和酸雾都能与氢氧化钠溶液反应,不能用于测定,故A不符合;
B.KMnO4溶液、稀H2SO4 与二氧化硫反应的方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,二氧化硫气体和高锰酸钾反应,高锰酸钾溶液紫红色褪去,故B符合;
C.碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故C符合;
D.氨水、酚酞试液,氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和二氧化硫和水又能反应生成亚硫酸氢铵,有两步反应,所以无法准确测定尾气中SO2含量,故D不符合;
故选:BC.
点评 本题考查了工业制备硫酸,明确工艺流程及设备作用,熟悉相关物质的性质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向盛有1mLmol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀产生,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转变为红褐色 | |
| C. | 重铬酸钾酸性溶液中加入乙醇,溶液由墨绿色变为橙黄色 | |
| D. | 用石墨作电极电解CuCl2溶液可观察到阳极石墨棒上覆盖一层红色的铜,阴极石墨棒上生成能使湿润碘化钾淀粉试纸变蓝的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com