
【题目】下列各组物质的晶体中,化学键类型、晶体类型都相同的是( )
A.CO2和SiO2B.H2S和H2OC.NaCl和HClD.CF2Cl2和CH3COONa
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.水玻璃中通入过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO ![]() +H2SiO3
+H2SiO3
B.澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO ![]()
C.硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D.二氧化硅溶于烧碱溶液中:SiO2+2OH﹣═SiO ![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图I所示装置进行实验。请回答下列问题:

(1)装置A中发生反应的化学方程式________。
(2)实验过程中,装置B、C中发生反应的现象分别是__________、________。
(3)反应开始一段时间后,观察到D装置试管中的品红溶液褪色后,停止通气,再对该试管加热,其现象为______________。若将Cl2直接通入品红溶液待褪色后再加热其现象是否与上述相同_________(填“相同”或“不相同”)。
(4)下列物质中,可用于吸收烟气中含有的少量SO2的是_________(填序号)。
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3·H2O
(5)该实验小组利用上述图II装置继续进行实验:通气一段时间后,实验过程中品红溶液几乎不褪色。试分析实验过程中,品红溶液几乎不褪色的原因是(用离子方程式表示): _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料: 材料一:如图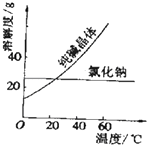
材料二:如表
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是;
(2)去除纯碱中的少量氯化钠杂质,最好应用;
(3)将乙二醇和丙三醇相互分离的最佳方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.分别测等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等
B.将CH3COONa溶液从25℃升温至 40℃,溶液中 ![]() 增大
增大
C.向硝酸中加入氨水至中性,溶液中 ![]() <1
<1
D.向AgCl、AgBr 的饱和溶液中加入少量 AgNO3 , 溶液中 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关药品的保存和使用不正确的是( )
A.溴水盛于带磨砂玻璃塞的细口瓶中
B.硫酸铜粉末、氯化钙等药品应贮存于干燥器中
C.白磷浸入水中密封保存
D.用碳酸钠滴定未知浓度的盐酸,碳酸钠盛于酸式滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO![]() =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。
【题型】综合题
【结束】
25
【题目】利用钛白工业的副产品FeSO4[杂质仅为少量[Fe2(SO4)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

(1)用离子方程式表示“除杂”的原理:__。
(2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是__。
(3)实验室测定副产品FeSO4杂质仅为少量[Fe2(SO4)3]+ Fe2(SO4)3含量的步骤如下:
步骤1:将适量副产品配成水溶液,向其中加入2molL-1BaCl2溶液使SO42-沉淀完全,过滤。
步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。
步骤3:用0.2000molL-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。
(该步骤中反应的方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2++4H2O)
①步骤1中证明SO42-沉淀完全的操作为__。
②欲配制0.2000 molL-1 KMnO4 50 mL,若定容时俯视,则所配KMnO4溶液浓度会__。(填“偏大”、“偏小”、“不变”)
③该副产品中所含杂质Fe2(SO4)3的物质的量为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com