
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸与锌反应放出的氢气多 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸和醋分别与锌反应的速度一样大 |
分析 n(Zn)=$\frac{0.03g}{65g/mol}$=0.0005mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.0005mol×2=0.001mol,H+浓度均为0.01mol/L的盐酸和醋酸,n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸恰好反应,醋酸为弱酸,则醋酸浓度大于盐酸,
A.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
B.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
C.反应速率与氢离子浓度成正比;
D.反应速率与氢离子浓度成正比.
解答 解:n(Zn)=$\frac{0.03g}{65g/mol}$=0.0005mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.0005mol×2=0.001mol,锌完全反应需要n(H+)=0.0005mol×2=0.001mol,H+浓度均为0.01mol/L的盐酸和醋酸,n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸恰好反应,醋酸为弱酸,则醋酸浓度大于盐酸,
A.醋酸过量、盐酸恰好反应,所以生成氢气的量与锌的质量成正比,两种溶液中锌的质量相等,所以放出的氢气一样多,故A错误;
B.根据A知,两种溶液中放出氢气一样多,故B正确;
C.醋酸是弱电解质,反应过程中醋酸不断电离出氢离子,导致反应过程中醋酸中的氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,故C正确;
D.根据C的分析,醋酸反应速率大于盐酸,故D错误;
故选C.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,首先根据酸、金属的量进行过量计算,然后根据弱电解质的电离特点来分析解答,很多同学往往不进行过量判断导致错误,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 汽油在上层,水在下层,水层无色 | B. | 汽油在下层,水在上层,汽油紫色 | ||
| C. | 汽油在上层,水在下层,汽油层无色 | D. | 汽油在下层,水在下层,汽油紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
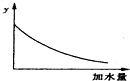
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 80% | C. | 10% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

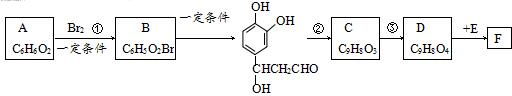
 ;D
;D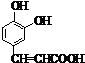 .
.
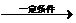
 +nH2O.
+nH2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com