
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
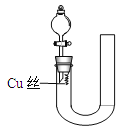
A. 应先打开活塞再从右侧加稀硝酸
B. 左侧稀硝酸须注满
C. 关闭活塞后铜丝会全部溶解
D. 反应停止后打开活塞气体变成红棕色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,测得1.32 g 某气体的体积为0.672 L,则此气体的摩尔质量为___________________。
(2)三种正盐的混合溶液中含有c(Na+)=0.2 mol·L–1、c(Mg2+)=0.25 mol·L–1、c(Cl–)=0.4 mol·L–1,则c(SO42-)为________mol·L–1。
(3)0.12 mol FeCl2加入100 mL K2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72–被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为____________ mol·L–1。
(4)现实验室要用质量分数为40%的浓氢氧化钠(密度为1.2 g·mL–1)来配制浓度为0.6 mol·L–1的稀氢氧化钠溶液100 mL,则需要这种浓碱的体积是__________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列化合物的名称或结构简式:
① _______________________________,
_______________________________,
②CH2=C(CH3)CH=CH2_______________________________,
③CH2=CHCOOH _______________________________,
④2,5-二甲基-2,4-己二烯的结构简式:_________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

①麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
②下列各物质:
A. 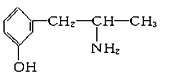 B.
B. 
C.  D.
D. 
E. 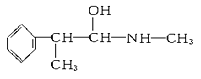
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】38.4gCu跟适量的浓HNO3反应,Cu全部反应后共收集到气体22.4L(标准状况),反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比( )
A. 5∶11 B. 6∶11 C. 5∶6 D. 6∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的认识错误的是
A.纯铁的硬度和强度低于铁合金
B.光导纤维的基本原料是硅
C.玻璃、水泥、陶瓷都是硅酸盐产品
D.长石主要成分为KAlSi3O8,可用氧化物形式表示为K2O●Al2O3●6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_______,发生反应的化学方程式是________________________。
(2)B中加入的物质是____________,其作用是_________________。
(3)实验时在C中观察到得现象是_______,发生反应的化学方程式是________________。
(4)实验时在D中观察到得现象是____________________,D中收集到的物质是_____________,检验该物质的方法和现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4— (绿色)、Cr2O72—(橙红色)、CrO42— (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______,离子方程式____________________________。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol·L1的Na2CrO4溶液中c(Cr2O![]() )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
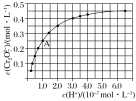
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________。
②由图可知,溶液酸性增大,CrO42—的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42—的平衡转化率减小,则该反应的ΔH_____0(填“大于”“小于”或“等于”)。(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42—生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×105molL1)时,溶液中c(Ag+)___molL1,此时溶液中c(CrO42—)等于_____molL1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com