
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了________(选填编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少 d.臭氧层空洞的减少
(2)步骤I生成无水MnSO4的化学方程式是________。步骤IV生成无水MnO2的化学方程式是________。
(3)步骤I中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是_______。滤渣M的成分是________。铜元素以________形式存在于滤渣N中。(写化学式)
(4)产品MnO2可作超级电容材料,用惰性电极电解MnSO4溶液可以制得MnO2,则MnO2在________生成。(填电极名称)
(5)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将2.0m3(标准状况)含SO2的体积分数为60%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量10.44kg。则在除去铁、铝、铜、镍等杂质的过程中,所引入的锰元素为________kg。
【答案】ac MnO2+SO2=MnSO4 2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2↓+2H2SO4 消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀 Al(OH)3、Fe(OH)3 CuS 阳极 1.32
【解析】
二氧化硫能与二氧化锰反应生成MnSO4,用MnCO3能通过调节溶液的pH使溶液中Al3+和Fe3+转化为Al(OH)3、Fe(OH)3沉淀除去,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰。据此解答。
(1)通过上述流程可以将含有SO2废气转化为MnSO4,能降低SO2对空气的污染,避免其形成酸雨,也减少了酸雨形成,因此脱硫实现了废弃物的综合利用,白色污染主要是塑料等难降解的物质形成的,臭氧空洞是由于氟卤代烃等形成,这两种环境问题都与SO2无关,故合理选项是ac;
(2)步骤I生成无水MnSO4的反应为二氧化锰和二氧化硫发生的反应,反应的化学方程式为:MnO2+SO2=MnSO4,步骤IV生成无水MnO2的反应是高锰酸钾在水溶液中氧化Mn2+形成,根据电子守恒、原子守恒,可得反应化学方程式为:2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2↓+2H2SO4;
(3)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解平衡正向移动,生成Al(OH)3、Fe(OH)3沉淀,因此滤渣M主要成分为Al(OH)3、Fe(OH)3,Cu2+会和加入的MnS溶解电离产生的S2-离子生成更难溶的CuS沉淀;
(4)Mn2+在阳极失电子转化为MnO2,阳极的电极反应式为:Mn2++2H2O-2e-=MnO2+4H+;
(5)反应的二氧化硫的物质的量n(SO2)=![]() ×60%×89.6%=48 mol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为48 mol,实际上最终生成的二氧化锰为10.44 kg,根据方程式2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2↓+2H2SO4可知:每反应消耗3 mol MnSO4,会产生5 mol MnO2,则反应产生10.44 kg MnO2,即产生MnO210440 g,消耗的MnSO4的物质的量为n(MnSO4)=
×60%×89.6%=48 mol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为48 mol,实际上最终生成的二氧化锰为10.44 kg,根据方程式2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2↓+2H2SO4可知:每反应消耗3 mol MnSO4,会产生5 mol MnO2,则反应产生10.44 kg MnO2,即产生MnO210440 g,消耗的MnSO4的物质的量为n(MnSO4)=![]() =72 mol;除去铁、铝、铜、镍等杂质时,所引入的锰元素(72 mol-48 mol)=24 mol,相当于Mn元素的质量=24 mol×55 g/mol=1320 g=1.32 kg。
=72 mol;除去铁、铝、铜、镍等杂质时,所引入的锰元素(72 mol-48 mol)=24 mol,相当于Mn元素的质量=24 mol×55 g/mol=1320 g=1.32 kg。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是( )
A.稀盐酸溶液与稀氢氧化钠的中和热:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol-1
B.FeCl3溶液水解的离子方程式:Fe3++3H2O![]() Fe (OH)3+3H+
Fe (OH)3+3H+
C.热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下KW=10-12,则0.05mol/LH2SO4溶液的pH=____ ,0.01mol/LNaOH溶液的pH=______ 。
(2)下列叙述中与盐类的水解有关的是(______)
①明矾和FeCl3可作净水剂
②实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释
③为保存FeCl3溶液,要在溶液中加少量盐酸
④用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全部有关
(3)若1 mol N2完全转化为NH3的反应热为△H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)已知25℃ 时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11 。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液④Na2CO3各25 mL,浓度均为0.1 mol·L-1四种溶液的pH由大到小的顺序为_________ (填序号)
(5)Na2CO3溶液加热后碱性增强,结合化学平衡移动原理解释原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B. 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C.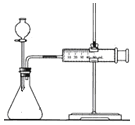 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D.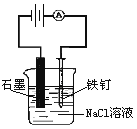 不可用来模拟氯碱工业
不可用来模拟氯碱工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
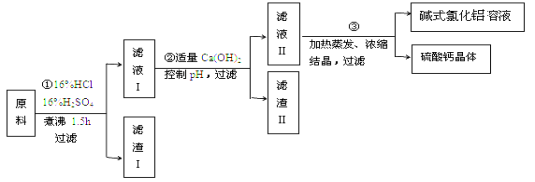
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,检验溶液中呈浅绿色的阳离子常采用加入_________溶液进行检验(填试剂化学式)。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,用离子方程式解释其原因为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3胶体时,吸收热量Q kJ ,该水解过程的热化学反应方程为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料。
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

(1)抑制FeCl3水解,溶液X为___________。
(2)流程中FeCl3能被异丙醚萃取,其原因是__________________________;检验萃取、分液后所得水层中是否含有Fe3+的方法是_______________________________________。
(3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是________________________。
(4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_____(填“甲”或“乙”)中。
![]()
下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是_____________。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是( )
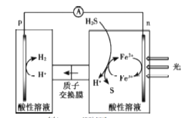
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com