
已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 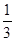 CO(g)
CO(g)
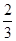 Fe3O4(s)+
Fe3O4(s)+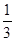 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:单选题
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是 ( )
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下图所示转化关系(X代表卤素),说法不正确的是
| A.2H(g) +2X(g) ="=" 2HX(g) ΔH3<0 |
| B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应3H2+N2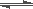 2NH3为放热反应,由此推断出 ( )
2NH3为放热反应,由此推断出 ( )
| A.氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应 |
| B.3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量 |
| C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量 |
| D.氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。下列说法不正确的是( )
| A.钠米金属燃料,更易点燃 |
| B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离 |
| C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果 |
| D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com