
分析 (1)碳酸钠能够与硫酸反应生成硫酸钠、二氧化碳和水;
(2)硝酸银与氯化钙反应生成氯化银沉淀和硝酸钙;
(3)铁粉能够与硫酸铜反应生成硫酸亚铁和铜.
解答 解:(1)碳酸钠能够与硫酸反应生成硫酸钠、二氧化碳和水,离子方程式:CO32-+2H+=CO2↑+H2O,可以用稀硫酸除去硫酸钠中的碳酸钠;
故答案为:稀硫酸;CO32-+2H+=CO2↑+H2O;
(2)硝酸银与氯化钙反应生成氯化银沉淀和硝酸钙,离子方程式:Ag++Cl-=AgCl↓,可以用硝酸银除去硝酸钙中的氯化钙,
故答案为:硝酸银;Ag++Cl-=AgCl↓;
(3)铁粉能够与硫酸铜反应生成硫酸亚铁和铜,离子方程式;Fe+Cu2+=Fe2++Cu;可以用铁粉除杂;
故答案为:Fe;Fe+Cu2+=Fe2++Cu.
点评 本题考查物质的除杂,主要涉及离子方程式的书写,明确物质的性质及离子反应实质是解题关键,注意除杂不能引人新的杂质,题目难度不大.


科目:高中化学 来源: 题型:实验题
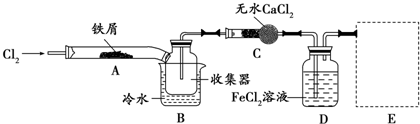
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
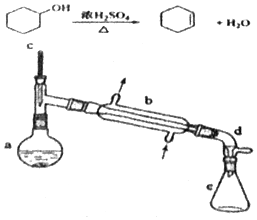 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4 L | B. | 11.2 L | C. | 14.0 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
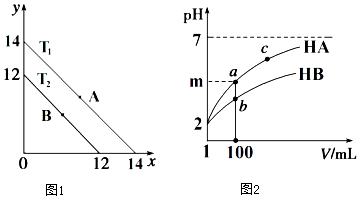 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com