
硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其同石灰乳混合可得“波尔多溶液”。实验室里需用480 mL 0.10 mol·L-1的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为
A.480 mL容量瓶,称取7.68 g硫酸铜
B.480 mL容量瓶,称取12.0 g胆矾
C.500 mL容量瓶,称取8.00 g硫酸铜
D.500 mL容量瓶,称取12.5 g胆矾
科目:高中化学 来源: 题型:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A、淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
B、为了增强漂白效果,可将二氧化硫和漂白粉混合使用
C、通常所用生理盐水的浓度为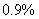
D、静电除尘是利用了胶体能发生丁达尔现象的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO
g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO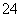 的物质的量浓度(mol·L-1)为
的物质的量浓度(mol·L-1)为
A. d B.
d B.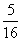 d
d
C.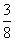 d D.
d D.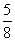 d
d
查看答案和解析>>
科目:高中化学 来源: 题型:
某地酸雨经检验除含H+外[c(OH-)可忽视]还有Na+、 Cl-、NH 、SO
、SO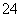 ,其浓度依次为:c(Na+)=2.3×10-5 mol·L-1,c(Cl-)=3.5×10-5 mol·L-1,c(NH
,其浓度依次为:c(Na+)=2.3×10-5 mol·L-1,c(Cl-)=3.5×10-5 mol·L-1,c(NH )=2.3×10-5 mol·L-1,c(SO
)=2.3×10-5 mol·L-1,c(SO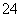 )=1.05×10-5 mol·L-1,则该地酸雨的pH为
)=1.05×10-5 mol·L-1,则该地酸雨的pH为
A.3 B.4
C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的氢气在氯气中燃烧,所得的混合物用100 mL 3.00 mol·L-1NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。求:
(1)原NaOH溶液中溶质的质量分数为________。
(2)所得溶液中Cl-的物质的量为________ mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物说法正确的是( )
①制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
②用灼烧的方法可以区别丝和棉花
③油脂水解可得到氨基酸和甘油
④纤维素和淀粉都是多糖,二者互为同分异构体
⑤溴乙烷、油脂和蛋白质在一定条件下都能水解
⑥乙醇中是否含水,可用金属钠来检验
⑦乙烯和乙烷都能发生加聚反应
⑧蛋白质水解的最终产物是多肽
A.①②③⑧ B.④⑤⑥⑦
C.②⑤ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料乙醇的生产过程可由下图表示:
玉米→ →
→ →
→ →
→ →
→ →乙醇
→乙醇
↓ ↓
CO2 废渣
(1)粉碎玉米的目的是______________________________。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是________。
(3)步骤a的操作是________。
A.蒸发 B.萃取
C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:_______________________________________。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:(C6H10O5)n+nH2O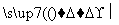 nC6H12O6
nC6H12O6
C6H12O6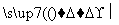 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇______ kg。(相对原子质量:C:12 H:1 O:16)
查看答案和解析>>
科目:高中化学 来源: 题型:
红矾钠(重铬酸钠:Na2Cr2O7 ·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2 ΔH<0(Na2CrO4在一定条件下可转化为Na2Cr2O7)
8Na2CrO4(s)+2Fe2O3(s)+8CO2 ΔH<0(Na2CrO4在一定条件下可转化为Na2Cr2O7)
(1)图1、图2表示上述反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是________________________(用文字表达);由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加了催化剂
c.通入O2 d.缩小容器体积

(2)工业上可用上述反应中的副产物CO2来生产甲醇,为测定反应速率,进行了如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500 ℃下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化曲线如图3所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化曲线如图3所示。

从反应开始到建立平衡,二氧化碳的平均反应速率v(CO2)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com