
| A. | 在浓氨水中加入生石灰可以制取少量的NH3 | |
| B. | 用水可以一次性鉴别溴苯、苯、乙酸三种物质 | |
| C. | 除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl | |
| D. | 实验室制备乙酸乙酯时,将溶液混合后需用大火迅速加热 |
分析 A.生石灰吸水放出大量的热,促进氨水挥发;
B.溴苯、苯都不溶于水,二者密度不同,乙酸易溶于水;
C.除去粗盐中的Ca2+、Mg2+、SO42-,可先除去镁离子、钡离子,再碳酸钠除去钙离子和过量的钡离子,最后用盐酸除去碳酸钠;
D.制备乙酸乙酯,应控制加热温度,减少乙酸、乙醇挥发.
解答 解:A.氨气易挥发,生石灰吸水放出大量的热,可促进氨水挥发,可用于制备氨气,故A正确;
B.溴苯、苯都不溶于水,二者密度不同,溴苯密度比水大,苯的密度比水小,乙酸易溶于水,可鉴别,故B正确;
C.除去粗盐中的Ca2+、Mg2+、SO42-,先加水溶解,可用氢氧化钡除去镁离子、钡离子,用碳酸钠除去钙离子和过量的钡离子,用盐酸除去碳酸钠,故C正确;
D.制备乙酸乙酯,应控制加热温度,减少乙酸、乙醇挥发,加热温度不能太高,故D错误.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质实验,把握化学反应原理、物质的性质为解答的关键,注意方案的评价性、操作性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
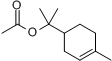 |
| 乙酸松油酯的结构式 |
| A. | 松油醇的分子式为C10H16O | |
| B. | 乙酸松油酯在NaOH溶液加热条件下得到的醋酸钠和松油醇 | |
| C. | 乙酸松油酯能发生加聚反应 | |
| D. | 乙酸松油酯能发生加成反应也能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
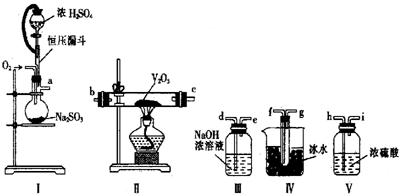
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
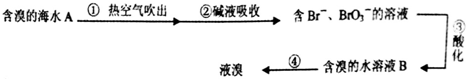
| A. | ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- | |
| B. | 第③步,需加人氧化性酸,才能将Br-氧化为Br2 | |
| C. | B溶液颜色要比A 溶液深 | |
| D. | 第④步,采用的是蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com