
【题目】随着科学技术的发展和环保要求的不断提高,![]() 废气的处理已成为研究的热点,图1是以
废气的处理已成为研究的热点,图1是以![]() 为主要原料的化工产品的生产过程。
为主要原料的化工产品的生产过程。

(1)关于侯氏制碱法,回答下列问题:
①写出![]() 的电子式______。
的电子式______。
②实验室制取![]() 的化学方程式______。
的化学方程式______。
③由侯氏制碱法获得![]() 分为两步:
分为两步:
I.![]()
II.______。
(2)尿素是重要的氮肥,请写出由![]() 生产尿素的化学方程式______。
生产尿素的化学方程式______。
(3)![]() 催化加氢制取汽油过程中发生如下反应:
催化加氢制取汽油过程中发生如下反应:
![]()
![]()
![]()
![]()
已知:在一定温度下,10L的密闭容器中,通入![]()
![]() 和
和![]()
![]() ,反应过程如图2所示,回答下列问题:
,反应过程如图2所示,回答下列问题:
①计算该温度下反应的平衡常数![]() ______。
______。
②下列可以判断该反应达到平衡状态的是______。
![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量
的减少量等于CO的生成量
![]() 反应容器内的压强不发生变化
反应容器内的压强不发生变化
![]() 混合气体中
混合气体中![]() 的浓度不再发生改变
的浓度不再发生改变
【答案】![]()
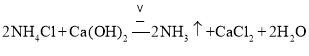
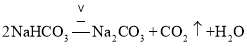
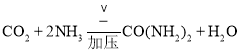 1 c
1 c
【解析】
![]() 属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;
属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;![]() 实验室制备氨气是利用氯化铵固体和氢氧化钙固体混合加热反应生成;
实验室制备氨气是利用氯化铵固体和氢氧化钙固体混合加热反应生成;![]() 由侯氏制碱法获得
由侯氏制碱法获得![]() 分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;![]() 尿素是重要的氮肥,原子守恒得到由
尿素是重要的氮肥,原子守恒得到由![]() 生产尿素的反应是二氧化碳和氨气反应得到;
生产尿素的反应是二氧化碳和氨气反应得到;![]() 结合三行计算列式计算平衡浓度,平衡常数
结合三行计算列式计算平衡浓度,平衡常数![]() ;
;![]() 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
![]() 属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,
属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,![]() 的电子式为
的电子式为![]() ;
;
![]() 实验室制取
实验室制取![]() 的化学方程式为:
的化学方程式为: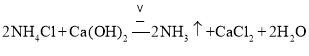 ,
,
故答案为: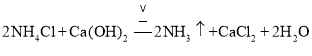 ;
;![]() 由侯氏制碱法获得
由侯氏制碱法获得![]() 分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,化学方程式为:
分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,化学方程式为:![]() ,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,化学方程式为:
,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,化学方程式为: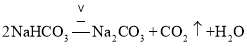 ,
,
故答案为: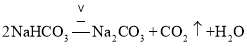 ;
;![]() 尿素是重要的氮肥,由
尿素是重要的氮肥,由![]() 生产尿素的反应是二氧化碳和氨气反应得到,反应的化学方程式:
生产尿素的反应是二氧化碳和氨气反应得到,反应的化学方程式: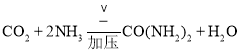 ,
,
故答案为:![]()
![]()
![]() ;
;![]() 图象可知二氧化碳物质的量变化:
图象可知二氧化碳物质的量变化:![]() ,氢气物质的量变化为
,氢气物质的量变化为![]() ,
,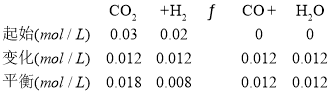
![]() ;
;![]() 反应为气体体积不变的吸热反应,
反应为气体体积不变的吸热反应,![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量,反应正向进行,不能说明正逆反应速率相同,故a错误;
的减少量等于CO的生成量,反应正向进行,不能说明正逆反应速率相同,故a错误;![]() 反应前后气体物质的量不变,反应容器内的压强始终不发生变化,不能说明反应达到平衡状态,故b错误;
反应前后气体物质的量不变,反应容器内的压强始终不发生变化,不能说明反应达到平衡状态,故b错误;![]() 混合气体中
混合气体中![]() 的浓度不再发生改变是平衡标志,故c正确;
的浓度不再发生改变是平衡标志,故c正确;
故答案为:c。


科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
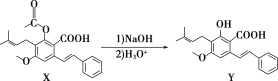
下列有关化合物X、Y的说法正确的是( )
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是_____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式_______。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)一氧化碳在工业上用途广泛,比如可以用来制备甲醇。甲醇是一种优质的液体燃料。利用甲醇,氧气,氢氧化钾溶液可以构成燃料电池。试写出该燃料电池的正极反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定溶液的pH时,应先将pH试纸润湿,然后进行检测
B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次混合溶液的pH
C.常温下若强酸强碱等体积中和后![]() ,则中和之前
,则中和之前![]()
D.在![]() 的某溶液中,水电离出的
的某溶液中,水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤
B.食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验
C.火柴头中的氯元素检验的实验中,将火柴头![]() 未燃烧
未燃烧![]() 浸于水中,片刻后取少量溶液,加
浸于水中,片刻后取少量溶液,加![]() 溶液、稀硝酸,若出现白色沉淀,证明有氯元素
溶液、稀硝酸,若出现白色沉淀,证明有氯元素
D.毒物误入口内,可将![]() 稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院
查看答案和解析>>
科目:高中化学 来源: 题型:
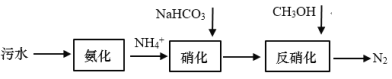
【题目】传统的生物脱氮主要包括有氧条件下的硝化反应过程和缺氧环境下的反硝化反应过程,其工艺如下图所示。硝化过程中,![]() 先后被氧化为
先后被氧化为![]() 和
和![]() 。
。![]() 硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的
硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的![]() 和
和![]() 还原为N2,如:5CH3OH +6
还原为N2,如:5CH3OH +6![]() = 3N2↑+5CO2+7H2O+6OH-
= 3N2↑+5CO2+7H2O+6OH-
(1)请写出![]() 硝化生成
硝化生成![]() 的离子方程式:________。
的离子方程式:________。
(2)若1mol![]() 继续被氧化为
继续被氧化为![]() ,需消耗O2____L。(标准状况)
,需消耗O2____L。(标准状况)
(3)现在很多国家采用半硝化工艺(ANAMMOX) ,工作原理如下图所示:
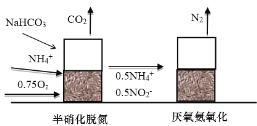
①写出厌氧氨氧化时![]() 与
与![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
②若采用该方法,请判断是否需要加入碳源(甲醇),并简述理由______。
(4)研究发现,脱氮工艺常会产生一种温室气体N2O,目前普遍认为形成于硝化阶段,则生成N2O的可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是
A.实验时手指不小心沾上苯酚,立即用浓NaOH溶液清洗
B.用润湿的红色石蕊试纸置于试管口,试纸变蓝,证明有氨气产生
C.将氯化铝溶液加热蒸发,最后可得到氯化铝晶体
D.酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.高锰酸钾溶液中,![]() 、
、![]() 、
、![]() 、葡萄糖分子能够大量共存
、葡萄糖分子能够大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() ,充分反应的离子方程式:
,充分反应的离子方程式:![]()
C.某温度下,![]() 的
的![]() 与
与![]() 混合溶液,一定存在
混合溶液,一定存在![]()
D.![]() ,已知
,已知![]() ,在
,在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.反应 ![]() ,增大压强该反应平衡常数增大
,增大压强该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D.改变条件,若反应物的转化率增大,平衡常数也一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com