
下列各组离子在水溶液中能大量共存的是
A.Ca2+、K+、CO32-、Cl- B.Ba2+、Na+、SO42-、NO3-
C.Ca2+、Na+、NO3-、Cl- D.H+、Na+、OH-、Cl-
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学式为 .
已知:CO(g)+1/2O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;S(s)+O2=SO2(g)△H=﹣296.0kJ•mol﹣1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)⇌2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.
则T1>T2(填“>”“<”),甲容器中反应的平衡常数K= .
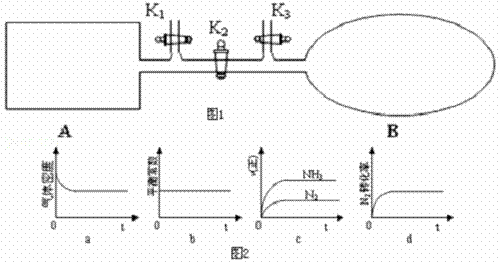
(3)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)⇌2NH3(g),起始时A、B的体积相同均为a L.
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)= .
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为 (用c1、c2、c3和>、<、=表示).已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10﹣5 mol•L﹣1,则该温度下0.1mol•L﹣1的NH4Cl溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:选择题
下列物质属于电解质的一组是
A.CO2、NH3、HCl
B.H2SO4、HNO3、BaCl2
C.H3PO4、H2O、Cu
D.液态KNO3、NaOH溶液、C2H5OH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:填空题
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:选择题
把1 L 0.1 mol/L醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是
A.c(CH3COOH)变为原来的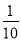
B.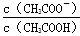 的比值增大
的比值增大
C. c(H+)变为原来的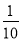
D.溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二12月月考化学试卷(解析版) 题型:填空题
(1)如图1是一种新燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
①写出A极发生的电极反应式______________________;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与____________极(填:“C”或“D”)相连;
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过__________克。
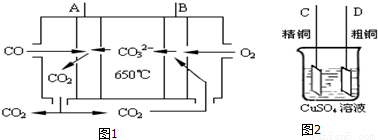
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_________(填“阴”或“阳”)极移动,阳极的电极反应式为______________;
②若阳极有28gFe溶解,则阴极析出的气体在标准状况下的体积为___________L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上12月月考化学试卷(解析版) 题型:填空题
红砖是用粘土高温烧结而成,因其颜色呈红色或棕红色而得名,常用作建筑材料
(1)根据红砖的颜色、猜测其可能含有的成份是 (写化学式)
(2)为了检验猜测是否正确,请根据以下设计的实验方案,简要地完成各步操作过程以及最后的实验分析和结论,涉及化学反应的写出化学方程式(实验用品任取,不必写实验装置中的仪器安装)
实验步骤:① 用铁锤敲碎红砖,取小块磨成粉末。
② 将红砖粉末放入烧杯,加入___________
③ 将混合液倒入过滤器___________
④ 在滤液中滴入___________
实验分析及结论: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上12月月考化学试卷(解析版) 题型:选择题
某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为

A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:选择题
将0.1mol·L-1 醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+2c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com