
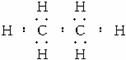
B、C、D、F四种元素均能与A形成等电子的四种分子,且化合物中各原子的个数比如下表:
化合物 | 甲 | 乙 | 丙 | 丁 |
原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶1 | F∶A=1∶1 |
(1)C的元素符号为___________,元素F在元素周期表中的位置为___________,化合物乙的分子式___________。
(2)丙在一定条件下可生成单质D2;在101 kPa时,0.5 mol D2与A2完全反应生成液态物质放出的热量为285.8 kJ,该反应的热化学方程式为___________。
(3)0.1 mol/L离子化合物EAB2D4溶液呈弱酸性,则溶液中离子浓度的大小顺序为_________________。
(4)化合物甲的电子式为___________,A、B、C、D四种元素中的某三种能形成多种与甲分子等电子的化合物,请写出其中任意一种化合物的分子式___________。
(1)N;第三周期、ⅦA族;N2H4;
(2)H2(g)+![]() O2(g)====H2O(l);ΔH=-285.8 kJ/mol;
O2(g)====H2O(l);ΔH=-285.8 kJ/mol;
(3)c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )>c(OH-);
)>c(OH-);
(4)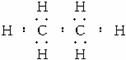 ,CH3OH或CH3NH2或NH2OH(其他合理答案同样也可)
,CH3OH或CH3NH2或NH2OH(其他合理答案同样也可)
解析:单质是密度最小的气体的元素A为H,有一种单质是自然界中硬度最大的物质的B元素为碳元素。由D的最外层电子数与次外层电子数的关系,可知D为O元素,则原子序数介于B(碳)、D(氧)元素之间的C元素为N元素。原子序数大于D(氧)且处于同一周期的E、F应位于第三周期,结合两者在题图中位置,可知E为Na,F为Cl。由所含原子及其个数比,可知甲为C2H6,乙为N2H4,丙为H2O2,丁为HCl。(3)EAB2O4为NaHC2O4,由其水溶液呈弱酸性,可知![]() 以电离为主,少量
以电离为主,少量![]() 按下式电离:
按下式电离:![]()
![]()
![]() +H+,导致c(Na+)>c(
+H+,导致c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )>c(OH-)。
)>c(OH-)。


科目:高中化学 来源: 题型:
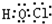
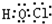
查看答案和解析>>
科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.

查看答案和解析>>
科目:高中化学 来源: 题型:
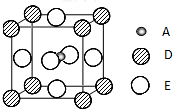 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:
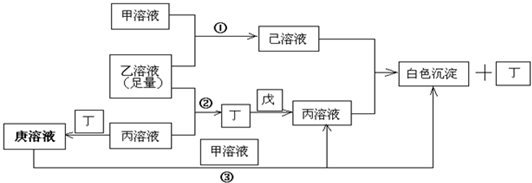




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com