
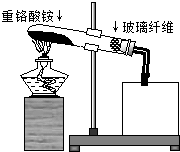
 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用:分析 (1)铜与稀硝酸反应氧化还原反应生成硝酸铜、NO气体和水;
(2)检验铵根离子的方法一般为:向铵盐中进入氢氧化钠、加热,用湿润的红色石蕊试纸检验是否有变蓝,从而判断是否含有铵根离子;
(3)反应中Cr元素和N元素的化合价发生变化,根据化合价升降相等配平并写出该反应的化学方程式;
(4)①反应中固体容易堵塞导管,且生成气体的气流不稳定,据此判断使用玻璃纤维的目的;
②氨气极易溶于水,需要使用防倒吸装置吸收氨气,检验氨气和氧气,需要选用硫酸亚铁溶液,据此设计方案并画出装置图;
③氨气与硫酸亚铁反应生成白色的氢氧化亚铁沉淀,据此证明存在氨气;氢氧化亚铁与氧气反应生成红褐色的氢氧化铁沉淀,据此判断反应中生成了氧气.
解答 解:(1)铜与稀硝酸反应反应生成硝酸铜、一氧化氮气体和水,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)通常用强碱溶液和湿润的红色石蕊试纸检验铵根离子,其操作方法、现象及结论为:取少量待测固体(或先配制成浓溶液亦可)于试管中,加入过量浓的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,产生无色有刺激性气味的气体,且试纸变蓝,则原溶液含有NH4+,
故答案为:取少量待测固体(或先配制成浓溶液亦可)于试管中,加入过量浓的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,产生无色有刺激性气味的气体,且试纸变蓝,则原溶液含有NH4+;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,(NH4)2Cr2O7中铬元素的化合价为+6,氮元素的化合价为-3,反应后分别生成Cr2O3、N2,铬元素化合价变化至少为:(6-3)×2=6,N元素化合价至少升高:[0-(-3)]×2=6,则化合价变化的最小公倍数为6,所以Cr2O3、N2的系数都是1,然后利用质量守恒配平可得(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O;
(4)①反应中固体容易堵塞导管,且生成气体的气流不稳定,所以使用玻璃纤维缓冲气流,防止固体被气流带进入堵塞导管,
故答案为:缓冲气流,防止固体被气流带进入导管,堵塞导管;
②检验氨气和氧气,发生的反应必须具有明显现象,如颜色变化、沉淀等,氨气能够与硫酸亚铁溶液反应生成氢氧化亚铁沉淀:2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4,氢氧化亚铁在溶液中遇到氧气能够被氧化成红褐色的氢氧化铁:4Fe(OH)2+O2+2H2O=4Fe(OH)3),所以用硫酸亚铁检验;氨气极易溶于水,需要用倒置的漏斗吸收氨气,据此画出的检验氨气和氧气的装置图为 ,故答案为:
,故答案为: ;
;
③根据②的分析可知,检验氨气的反应原理为:2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4;检验氧气的反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:2NH3+2H2O+FeSO4=Fe(OH)2↓+(NH4)2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3)(或8NH3+10H2O+4FeSO4+O2=4Fe(OH)3↓+4(NH4)2SO4).
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确常见物质的性质及检验方案的设计原则为解答关键,注意掌握化学实验基本操作方法及其应用,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦⑧ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com