
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
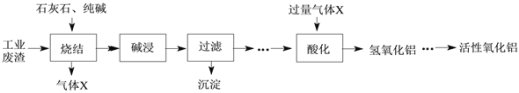
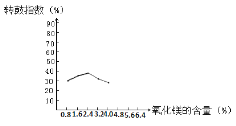
(1)烧结时往往需要加入MgO以提高烧结产物的转鼓指数,下图是转鼓指数与MgO含量的关系曲线。根据此图可知,最适宜的MgO含量是____%。
(2)烧结产物主要有NaAlO2、Ca2SiO4、NaFeO2及气体X。气体X是____。
(3)碱浸前需将烧结产物进行粉碎,其目的是____。碱浸过程中,NaFeO2可与水反应生成NaOH和一种含铁的化合物,该含铁的化合物是____。
(4)酸化时发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C ![]() 2Sn + a M↑ + CO2↑,则下列说法中错误的是
2Sn + a M↑ + CO2↑,则下列说法中错误的是
A. a的值为2 B. 反应中SnO2被还原
C. 每生成1 mol M转移电子8 mol D. 反应后有两种氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 ,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol∕L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
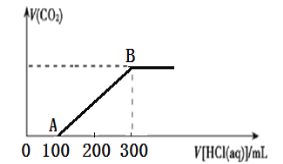
(1)OA段、AB段发生反应的离子方程式:_____________________、___________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____________。
(3)原NaOH溶液的物质的量浓度是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为_______。但NCl5不存在,其原因是________________________;
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。

直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:_______;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为________。
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式)______g·cm-3(NA为阿伏加德罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A. 用分液的方法分离汽油和煤油
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 不慎将苯酚溶液沾到皮肤上,立即用稀NaOH溶液清洗
D. 用饱和溴水除去苯中的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com