
【题目】溶液、胶体与浊液的本质区别是
A.分散系是否有颜色B.分散质粒子的大小
C.能否透过滤纸D.是否有丁达尔效应
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法不正确的是

A. ![]() 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为![]() 的反应为:
的反应为:![]()
B. 电子从![]() 流出,经外电路流向
流出,经外电路流向![]()
C. 如果将反应物直接燃烧,能量的利用率不变
D. 若该电池电路中有![]() 电子发生转移,则有
电子发生转移,则有![]() 通过质子交换膜
通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有3种,其分子量分别为70、72、74在天然单质中,此三种单质分子的物质的量之比为7:2:1,由此推断洗下结论中,正确的是
A.此元素有3种同位素
B.其中质量数为35的同位素原子占原子总数的1/4其中一种同位素质量数为80
C.其中一种同位素质量数为37
D.此元素单质的平均分子量为72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,下图为某种锂离子电池放电时有关离子转化关系。下列有关说法正确的是
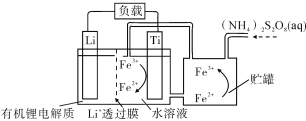
A. 电池中Li+透过膜两侧的电解质可以互换
B. 充电时,Li+通过Li+透过膜从右侧向左侧移动
C. 充电时,钛电极作阴极,电极反应式为:Fe3++e===Fe2+
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+===Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业的基础,下图是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水,通电几分 钟后,将湿润的淀粉碘化钾试纸放在A电极一端的管口,试纸变蓝色,请回答:
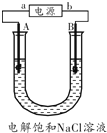
(1)b端为电源的_______极;请用化学方程式解释使湿润的淀粉淀化钾试纸变蓝的原因_____________
(2)写出B极的电极反应式_______
(3)若在U形管的两端分别滴加无色酚酞溶液,则一段时间后_____极(填“A”或“B”)呈红色
(4)请写出电解饱和食盐水的化学方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO![]() +4H2O
+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com