
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
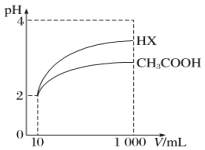
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
【答案】 H2CO3 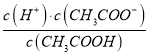 HCO3-
HCO3-![]() CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
【解析】本题考查电离平衡常数、电离方程式的书写,(1)电离平衡常数越大,说明电离程度越大,三种酸酸性强弱的顺序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的电离:CH3COOH![]() CH3COO-+H+,依据电离平衡常数的表达式,即Ka=
CH3COO-+H+,依据电离平衡常数的表达式,即Ka= ;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3
;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O![]() H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O![]() H3O++CO32-,碳酸的第二步电离为:HCO3-
H3O++CO32-,碳酸的第二步电离为:HCO3-![]() H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O![]() H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。


科目:高中化学 来源: 题型:
【题目】.在一定温度和压强下,2体积X2(g)跟3体积Y2(g)化合生成2体积化合物M(g),则化合物M的化学式是( )
A.XY3B.X2Y3C.X3YD.XY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,硫氢化钾溶液里存在下列平衡:a.HS-+H2O![]() OH-+H2S b.HS-
OH-+H2S b.HS-![]() H++S2-
H++S2-
(1)平衡a是__________平衡;平衡b是________平衡。(填“电离”或“水解”)
(2)向KHS溶液中加入氢氧化钠固体时,c(S2-)将________(填“增大”“ 减小”或“不变”,下同);向KHS溶被中通入HCl时,c(HS-)将______________。
(3)向KHS溶液中加入硫酸铜溶被时,有黑色沉淀(CuS)产生,则平衡a_________(填“正向” “逆向”或“不”,下同)移动,平衡b___________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙分别是甲烷、乙烯、苯中的一种;①甲能使溴水褪色,甲分子中所有原子共平面。②乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色。③丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应。一定条件下,1 mol丙可以和3 mol H2完全加成。
(1)甲基的电子式为____________,丙的结构简式为____________。
(2)丙与液溴在催化剂作用下发生取代反应的化学方程式是____________________;其有机产物中所有原子是否共平面_______(填“是”或“否”)。
(3)丙与H2发生的反应类型是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象是造成有机物种类繁多的重要原因之一。下列各组物质互为同分异构体的是
A. 甲烷与丙烷 B. CH2=CH2与CH3CH3
C. 纤维素与淀粉 D. CH3CH2OH与CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
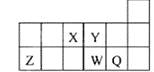
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
C. 元素W与Q的最高价氧化物对应的水化物的酸性W的强
D. 元素X与元素Z的最高正化合价之和的数值等于8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铁矿石、焦炭、空气、石灰石为原料来冶炼铁。
(1)请写出用磁铁矿在高温下冶炼铁的化学方程式___________。请你用化学方法设计实验方案检验上述反应得到的固体产物中含有铁粉___________。
(2)小明同学将用冶炼所得的铁粉按下图装置来制备 Fe(OH)2,实验开始时应先_______活塞a,___________活塞 b(填“打开”或“关闭”)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com