
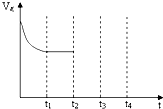
 目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
目前,全国多个地区为雾霾所困,氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.| x |
| (0.8-2x)+(0.7-2x)+x+2x |
| ||
| 5s |
| (0.7-0.3×2)mol |
| 2L |
| (0.8-0.3×2)mol |
| 2L |
| 0.3mol |
| 2L |
| 0.3mol×2 |
| 2L |
| 0.15×0.32 |
| 0.052×0.12 |
 ,
,


科目:高中化学 来源: 题型:阅读理解
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是___________和___________。当另一种具有___________(性质)的液态洁污剂与之混合时,可能发生如下反应而产生氯气:______________________。
(Ⅱ)当今世界存在着两大类环境问题。一类是在工业化过程中排放大量废水、废气、废渣带来的环境污染问题;另一类是由于不合理开发利用自然资源导致的森林锐减、水土流失、土地沙漠化和物种灭绝等生态破坏问题。据此,请回答下列问题:
(1)中国是发展中国家,上述两类问题兼而有之,你认为我国目前最严重的是哪一类问题?________________
(2)你认为(1)中这一类问题在很大程度上是由下列哪一项造成的( )
A.贫困 B.工业高度发展 C.生活富裕 D.农业发展
(3)工厂的产值不一定都是“正”产值,它还产生“负”产值。例如,炼钢厂生产钢铁,当然会给GDP(国民生产总值)增加正产值,但同时由于排放废气、废水、废物,污染了环境,弄脏了河水,又产生了负产值。下列哪种生产不会带来很高的负产值( )
A.接触法制硫酸 B.氨氧化法制硝酸
C.采用大棚培养反季蔬菜 D.五金电镀车间生产电镀零件
(4)森林的大幅度锐减,除了造成水土流失、土地沙漠化和物种灭绝外,还会带来什么危机?
____________________________________________________________________。
(5)在我国城市环境中,往往是重工业发达的地区污染也最严重。请写出几个我国工业发达的城市:(至少两个)________________________________________________________________。
(6)“保护环境,就是保护人类自己。”目前,在我国城市环境中主要的大气污染物是____________________________________________________________________。
(7)在全国各省、市、自治区的主要城市都设有大气监测站,主要工作是监测大气情况,且每天都公布空气质量情况下。下列各项的含量一定会进行监测的是___________。
①可吸入颗粒物 ②总悬浮颗粒物 ③氮氧化物 ④二氧化碳 ⑤二氧化硫 ⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
(8)我国政府已经注意到了环境污染的危害性,因此___________和计划生育是我国最基本的国策。并专门制订了一部法律称为___________。
(9)环境问题的重要性也成为各国申办奥运会的注意点。各国纷纷打出“环境”牌,并将其放在第一位,我国也不例外。北京为申办2008年奥运会除喊出“新北京”、“新奥运”外,还提出申办的三个理念:人文奥运,科技奥运,还有一个是什么? ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com