
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1molCl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
分析 A.反应中H2O2中氧元素化合价升高,作还原剂,KMnO4是氧化剂;
B.由元素化合价可知,反应中只有亚铁离子被氧化,结合电子转移守恒计算判断;
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价;
D、氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
解答 解:A.反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,H2O2中氧元素化合价升高,生成氧气,所以H2O2作还原剂,则其余产物为H2O和O2,故A正确;
B.由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正确;
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,则氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+,故D错误.
故选:D.
点评 本题考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,难度中等,注意氧化还原反应中电子守恒的运用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离饱和食盐水与醇的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后必须烘干才能进行溶液的配制 | |
| C. | 分馏石油时,温度计的水银求必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷不能发生氧化反应 | B. | 乙烯和苯均能发生加成反应 | ||
| C. | 乙醇和乙酸乙酯都易溶于水 | D. | 甲苯中所有原子可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
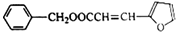 )的合成路线:
)的合成路线:

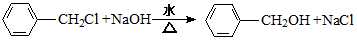 .A+D→E的反应类型为酯化反应.
.A+D→E的反应类型为酯化反应.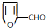 ,其最多有11个原子共平面.
,其最多有11个原子共平面. 与苯环相连;③能够发生水解反应④能够发生银镜反应.
与苯环相连;③能够发生水解反应④能够发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 冰融化成水放出热量 | |
| B. | 化学键断裂过程一定放出能量 | |
| C. | 生成物的总能量一定低于反应物的总能量 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gCO和C2H4混合气体中的碳原子数为NA | |
| B. | 1molN2与3molH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| D. | 32g硫粉与足量的Cu粉完全反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com