
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
分析 A.ⅡA族为碱土金属元素,全为金属;
B.ⅤⅡA族为卤素,均为非金属元素;
C.周期表中的金属元素长周期、短周期均有;
D.副族和第ⅤⅢ族均为金属,非金属元素在主族和0族.
解答 解:A.ⅡA族为碱土金属元素,全为金属,其它主族中均有非金属元素,故A错误;
B.ⅤⅡA族为卤素,均为非金属元素,其它主族中均有金属元素,故B错误;
C.周期表中的金属元素,例如Li在第二周期,属于短周期,故C错误;
D.副族和第ⅤⅢ族均为金属,周期表中的非金属元素都位于主族和0族,故D正确;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素在周期表中的位置为解答的关键,注意周期、族的划分及金属元素与非金属元素的排布,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>AsH3>PH3 | B. | 熔点:Cs>Li>Na | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
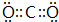 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯(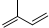 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 甲醇在铜催化和加热条件下生成的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com