
| A. | ②③ | B. | ①③④ | C. | ①② | D. | ②③④ |
分析 ①沉淀的转化向溶度积更小的方向移动;
②K=$\frac{c(F{e}^{2+})}{c(C{u}^{2+})}$;
③加入少量Na2S固体后,CuS更难溶,Cu2+、S2-发生反应生成沉淀;
④开始浓度未知,不能确定平衡浓度的关系.
解答 解:①沉淀的转化向溶度积更小的方向移动,可知FeS的Ksp大于CuS的Ksp,故正确;
②K=$\frac{c(F{e}^{2+})}{c(C{u}^{2+})}$=$\frac{c(F{e}^{2+})×c({S}^{2-})}{c(C{u}^{2+})×c({S}^{2-})}$=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$,故正确;
③加入少量Na2S固体后,CuS更难溶,先Cu2+、S2-发生反应生成沉淀,则溶液中c(Cu2+)减小,故错误;
④开始浓度未知,不能确定平衡浓度的关系,则c(Fe2+)、c(Cu2+)平衡时不一定相等,故错误.
故选C.
点评 本题考查难溶电解质的转化,为高频考点,把握沉淀转化的实质、K与Ksp的关系为解答的关键,侧重分析与应用能力的考查,注意溶度积小的先转化为沉淀,题目难度不大.


科目:高中化学 来源: 题型:解答题
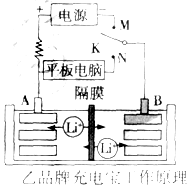 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 | |
| B. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| C. | 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 | |
| D. | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
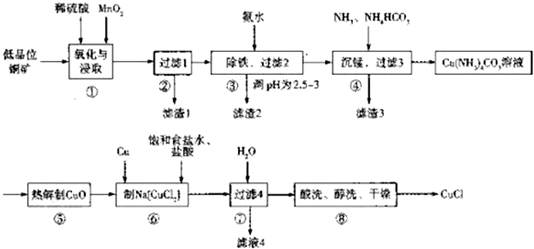
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
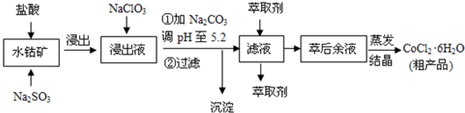
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com